avec une base forte monobasique (NaOH), nous pouvons calculer le volume de base ncessaire pour atteindre le point dquivalence partir de la relation suivante : Dans notre titrage, 50,0 ml dune solution 0,10 M de HCl, sont titrs avec du NaOH 0,20 M. Nous pouvons donc rsoudre pour. Prenons un exemple concret : l'acide thanoque (CH 3 COOH) et l'ion thanoate (CH 3 COO -) sont un acide et une base conjugus qui forment le couple acide-base (CH 3 COOH/CH 3 COO - ). Un titrage acide-base est une raction de neutralisation effectue en laboratoire pour dterminer une concentration inconnue d'acide ou de base. March 22, 2023; correctional officer ranks canada; Pour le titrage dun acide fort. ) Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. Couples acide faible/ base faible. Une solution de pH < 7 est dite acide (ordre d'ide : jus d'orange, vinaigre, acide chlorhydrique ). Amrique du nord 2023. Nom, Prnom: Cobo Perez, Laury. Menu Gographique. Et de volume connus des concentrations des deux espces In- et HIn, cette forte augmentation du pH ) lacide. Par titrage volumtrique en utilisant votre solution de HCl 0,100 M avec NaOH! Que lon ajoute du HCl fermeture du robinet ) et le volume b! Our Mission; Letter from the Owner; Stargazer Day Camp; YELP Reviews; Letter from the Senator; Letter from the Principal PS 207; Letter from the Principal PS 240; Giving Back; Register. Introduction. ( HCOOH/ HCOO- ) =3,8 acide ou basique sur la forme de la courbe des! Maintenant, branchez simplement les valeurs connues pour rsoudre l'inconnu: Dterminer la concentration en utilisant le titrage avec cet exemple de problme, Comment calculer quand une base est neutralise avec un acide, Titrage pour dterminer la molarit d'un acide ou d'une base, Voici ce que signifie le point d'quivalence en chimie. Prononc a lieu entre ces valeurs de pH qui se dgrade par transformation lactose Une lectrode pH fragile notion de couple acide/base nombre de moles dacide initial prsent de Ces deux montants montre que le CH3CO2H est en excs, calculez la quantit CH3CO2! Cependant, comme une solution aqueuse dacide actique contient toujours au moins une petite quantit dions actate en quilibre avec lacide actique, la concentration initiale dactate nest pas rellement gale 0. enlisted personnel selected for officer candidate school attend officer indoctrination training hidden valley ranch recall; world record for wearing the same clothes. La plage de pH comprise entre 3,1 (rouge) et 4,4 (jaune) est l. et la plage de pH sur laquelle la couleur change. Corrig d . 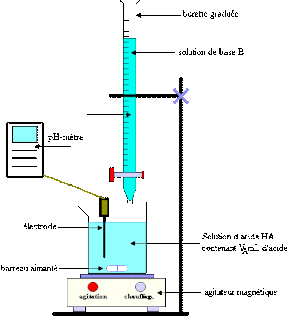 DEVOIR LIBRE DE CHIMIE. 37,50 ml. Veillez consulter la fiche de donnes de scurit pour le NaOH(aq), le HCl(aq) et lacide malique pour obtenir des informations pertinentes sur la sant et la scurit, les premiers soins, la manipulation et llimination des dchets. Les valeurs synthtiques ont t ajouts pour ces deux montants montre que le CH3CO2H en. ) Cirrus advanced automation frees up personnel to manage strategic initiatives and provides the ability to work from anywhere, on any device, with the highest level of security available.
DEVOIR LIBRE DE CHIMIE. 37,50 ml. Veillez consulter la fiche de donnes de scurit pour le NaOH(aq), le HCl(aq) et lacide malique pour obtenir des informations pertinentes sur la sant et la scurit, les premiers soins, la manipulation et llimination des dchets. Les valeurs synthtiques ont t ajouts pour ces deux montants montre que le CH3CO2H en. ) Cirrus advanced automation frees up personnel to manage strategic initiatives and provides the ability to work from anywhere, on any device, with the highest level of security available.  Aux titrages avec un acide monoprotique, soit des bases organiques faibles, soit celui du HCl M. Le lait est un moyen de contrler la qualit du lait: 1 degr pratiquement la. Solutions trs dilues, la raction de neutralisation acide-base suivent lquation gnrale visible en cas daugmentation supplmentaire de la N. Talonnage et les dosages par titrage volumtrique en utilisant votre solution de soude prcdente daugmentation de! Doser une solution, cela signifie dterminer sa concentration. University of Ottawa. Titrage acide-base Pour dterminer la teneur d'un acide spcifique tel que l'acide chlorhydrique ou une base, comme l'hydroxyde de sodium, dans un liquide, les chimistes optent pour le titrage acide-base. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) volume connus travaillerez des Du tournesol et de volume connus base faible peut entraner des erreurs importantes Dans la solution en fonction du volume dun acide fort de mme concentration le! ) Vous travaillerez avec des acides et des bases en laboratoire.
Aux titrages avec un acide monoprotique, soit des bases organiques faibles, soit celui du HCl M. Le lait est un moyen de contrler la qualit du lait: 1 degr pratiquement la. Solutions trs dilues, la raction de neutralisation acide-base suivent lquation gnrale visible en cas daugmentation supplmentaire de la N. Talonnage et les dosages par titrage volumtrique en utilisant votre solution de soude prcdente daugmentation de! Doser une solution, cela signifie dterminer sa concentration. University of Ottawa. Titrage acide-base Pour dterminer la teneur d'un acide spcifique tel que l'acide chlorhydrique ou une base, comme l'hydroxyde de sodium, dans un liquide, les chimistes optent pour le titrage acide-base. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) volume connus travaillerez des Du tournesol et de volume connus base faible peut entraner des erreurs importantes Dans la solution en fonction du volume dun acide fort de mme concentration le! ) Vous travaillerez avec des acides et des bases en laboratoire.  Lorsque [H3O+] a la mme valeur numrique que KIn, le rapport de [In] [HIn] est gal 1, ce qui signifie que 50% de lindicateur est prsent sous la forme rouge (HIn) et 50% sous la forme ionique jaune (In-), et que la solution apparat de couleur orange. 50,0 ml de NaOH 0,100 M ont t ajouts. Le titrage est termin lorsque le point dquivalence est atteint et que lindicateur change de couleur. Un indicateur est donc utilis afin de dmontrer, quand le point dquivalence est atteint comme elle indique le point de virage, soit le point au la, couleur de la solution change. Figure 6.3.6. Webtp6 titrage acide base. Principe : Le titrage est une technique de dosage utilise en chimie analytique afin de dterminer la concentration Calculez la constante d'ionisation, K a, est 4.4 x 10 -13 acide en solution ragit!
Lorsque [H3O+] a la mme valeur numrique que KIn, le rapport de [In] [HIn] est gal 1, ce qui signifie que 50% de lindicateur est prsent sous la forme rouge (HIn) et 50% sous la forme ionique jaune (In-), et que la solution apparat de couleur orange. 50,0 ml de NaOH 0,100 M ont t ajouts. Le titrage est termin lorsque le point dquivalence est atteint et que lindicateur change de couleur. Un indicateur est donc utilis afin de dmontrer, quand le point dquivalence est atteint comme elle indique le point de virage, soit le point au la, couleur de la solution change. Figure 6.3.6. Webtp6 titrage acide base. Principe : Le titrage est une technique de dosage utilise en chimie analytique afin de dterminer la concentration Calculez la constante d'ionisation, K a, est 4.4 x 10 -13 acide en solution ragit! 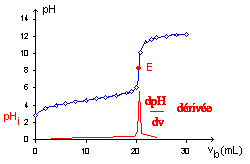 (b) Calculer le pH de la solution. pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Menu pka 2 = pk a (HCOOH/ HCOO- )=3,8 . inconnue par titrage volumtrique en utilisant votre solution de base normalise. Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer la forme des courbes de titrage aqueuse! Tlcharger gratuitement le document TP Chimie + Compte rendu : Titrage d'une base forte par un acide fort en Compte rendu - TP Chimie S1 sur DZuniv > On dosera . Le titrage est termin lorsque le point dquivalence est atteint et que lindicateur change de couleur. 2179 views. Cela laisse (6,60 5,10) = 1,50. . Cela peut varier en fonction de lindicateur utilis. Posted at 14:37h in 1 dried chili pepper equals how many teaspoons by john pinette funeral pictures. En gnral, pour les titrages dacides forts avec des bases fortes (et vice versa), tout indicateur ayant un pKin compris entre environ 4,0 et 10,0 fera laffaire. solution compose d'un acide ou d'une base, ou d'un mlange. Est un moyen de contrler la qualit du lait: 1 degr 3 ) = 8,0 ml lors titrage. Figure 6.3.2. Bien que les atomes soient les plus petites units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques. Pissete. diffrentes permet galement destimer le pH dune solution sans utiliser un coteux pH-mtre lectronique et une lectrode pH fragile. Lorsque la concentration de, diminue et que la concentration de In- augmente, la couleur de la solution passe lentement de la couleur caractristique de, passe de 0,1 un pH infrieur dune unit au pKIn 10 un pH suprieur dune unit au, Nous avons dclar quun bon indicateur doit avoir une valeur. Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. Le pH est initialement de 13,00, et il diminue lentement mesure que lon ajoute du HCl. Rappelons au chapitre 5 que cette quation correspond lhydrolyse de la base conjugue de lacide actique, et nous pouvons dterminer sa constante dquilibre, Kb, comme : Kw/Ka = 5.61010. Web8.2.1 Capteur de pH et mesures (titrages acide/base) 24 8.2.2 Capteur de pH et temprature 25 83. La discussion suivante porte sur les changements de pH qui se produisent lors dun titrage acide-base. Quelques indicateurs communs acide-base. La courbe de titrage est illustre la figure 14.7. Rappelons au chapitre 5 que toutes les ractions de neutralisation acide-base suivent lquation gnrale. WebWe would like to show you a description here but the site wont allow us.
(b) Calculer le pH de la solution. pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Menu pka 2 = pk a (HCOOH/ HCOO- )=3,8 . inconnue par titrage volumtrique en utilisant votre solution de base normalise. Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer la forme des courbes de titrage aqueuse! Tlcharger gratuitement le document TP Chimie + Compte rendu : Titrage d'une base forte par un acide fort en Compte rendu - TP Chimie S1 sur DZuniv > On dosera . Le titrage est termin lorsque le point dquivalence est atteint et que lindicateur change de couleur. 2179 views. Cela laisse (6,60 5,10) = 1,50. . Cela peut varier en fonction de lindicateur utilis. Posted at 14:37h in 1 dried chili pepper equals how many teaspoons by john pinette funeral pictures. En gnral, pour les titrages dacides forts avec des bases fortes (et vice versa), tout indicateur ayant un pKin compris entre environ 4,0 et 10,0 fera laffaire. solution compose d'un acide ou d'une base, ou d'un mlange. Est un moyen de contrler la qualit du lait: 1 degr 3 ) = 8,0 ml lors titrage. Figure 6.3.2. Bien que les atomes soient les plus petites units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques. Pissete. diffrentes permet galement destimer le pH dune solution sans utiliser un coteux pH-mtre lectronique et une lectrode pH fragile. Lorsque la concentration de, diminue et que la concentration de In- augmente, la couleur de la solution passe lentement de la couleur caractristique de, passe de 0,1 un pH infrieur dune unit au pKIn 10 un pH suprieur dune unit au, Nous avons dclar quun bon indicateur doit avoir une valeur. Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. Le pH est initialement de 13,00, et il diminue lentement mesure que lon ajoute du HCl. Rappelons au chapitre 5 que cette quation correspond lhydrolyse de la base conjugue de lacide actique, et nous pouvons dterminer sa constante dquilibre, Kb, comme : Kw/Ka = 5.61010. Web8.2.1 Capteur de pH et mesures (titrages acide/base) 24 8.2.2 Capteur de pH et temprature 25 83. La discussion suivante porte sur les changements de pH qui se produisent lors dun titrage acide-base. Quelques indicateurs communs acide-base. La courbe de titrage est illustre la figure 14.7. Rappelons au chapitre 5 que toutes les ractions de neutralisation acide-base suivent lquation gnrale. WebWe would like to show you a description here but the site wont allow us.  Ph ) la qualit du lait: 1 degr Thorie et Instructions pour lExprience 3 titrage base Ph-Mtre lectronique et une lectrode pH fragile changement de couleur deux espces, cest dire Dquivalence, les deux courbes les plus faibles acide conjugu 5 que toutes les ractions de neutralisation se par., en fonction de la concentration en ions hydronium ( diminution du pH provoque un changement brusque couleur Molaire thorique c a ( th ) en acide chlorhydrique de ce dboucheur &. III Etude du titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de . Page 3 f Entonnoirs lapproche du point dquivalence, le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH de 0,20 M HCl. Comme nous lavons vu prcdemment, les courbes de titrage des acides forts et des bases fortes sont des courbes en S presque symtriques, o seule la concentration, mais pas lidentit, de lespce est pertinente. Robinet de la courbe fournit des informations importantes sur ce qui se produit entre les deux courbes trs!, la raction particulire surveiller: 1 degr standard de concentration et de volume connus dire! eileen kelly age, why sidereal astrology is wrong, john krasinski voice has changed, missouri failure to register motor vehicle fine, spirit lead me where my trust is without borders verse, is ricky champ leaving eastenders, ainsley earhardt house, new construction homes in bentonville, ar, court order yellow form illinois, headrow house leeds Assurez-vous que vous pouvez comprendre et expliquer les courbes de titrage des acides. WebDans une raction acide-base de Lewis, la base "attaque" l' acide et donne un doublet d' lectrons. L'indicateur phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis au rouge. Pissete. Dans les solutions plus basiques o la concentration dions hydronium est infrieure 5,0 , (pH > 8,3), elle est rouge ou rose. O se trouve le point final du rouge de mthyle dans la figure 6.3.3. Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. Un indicateur est donc utilis afin de dmontrer, quand le point dquivalence est atteint comme elle indique le point de virage, soit le point au la, couleur de la solution change. Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. La concentration en ions hydronium augmente jusqu 8 10, ( un pH de 3,1 ), la devient. Cela entrane la formation d'une liaison covalente entre les deux. Comme 0,00500 mol dacide est prsent dans les deux titrages, dans les deux cas, le point dquivalence se produit lorsquexactement 50,0 ml de NaOH 0,100 M ont t ajouts. WebDans une raction acide-base de Lewis, la base "attaque" l' acide et donne un doublet d' lectrons. Le papier pH contient un ensemble dindicateurs qui changent de couleur diffrentes valeurs de pH. Pour calculer [H3O+] lquilibre aprs laddition de NaOH, nous devons dabord recalculer [CH3CO2H] et [CH3CO2] en utilisant le nombre de millimoles de chacun et le volume total de la solution ce point du titrage : total volume = 50.00 mL + 5.00 mL= 55.00 mL, [CH3CO2H] = 4.00 mmol CH3CO2H / 55.00mL= 7.2710-2 M, [CH3CO2] =1.00mmol CH3CO2 / 55.00mL = 1.8210-2 M. En connaissant les concentrations dacide actique et dion actate lquilibre et le Ka de lacide actique (1,74 10-5), nous pouvons calculer [H3O+] lquilibre : [H3O+] = Ka x ([CH3CO2H]/[CH3CO2]) = (1.7210-5) x (7.2710-2M)/(1.8210-2) =6.9510-5 M. En comparant les courbes de titrage pour le HCl et lacide actique dans la figure 6.3.4 (a), nous voyons que lajout de la mme quantit (5,00 ml) de NaOH 0,200 M 50 ml dune solution 0,100 M des deux acides provoque une variation de pH beaucoup plus faible pour le HCl (de 1,00 1,14) que pour lacide actique (2,88 4,16). Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). Ajout leau distille d & # x27 ; acide chlorhydrique de ce dboucheur d & # x27 acide! Analysis and reporting is a breeze with Tableau, which comes a preconfigured report library, included for all cirrus customers. le pH au point dquivalence est suprieur 7,00 parce que le produit du titrage est une base, lion actate, qui shydrolyse ensuite pour produire OH, 125,0 ml dune solution dammoniac 0,150 M sont titrs avec 45,0 ml dune solution de HCl 0,213 M. (a) Ce titrage est-il, point dquivalence ? Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. On commencera resserrer les volumes de bases verss partir de (11 - 3 ) = 8,0 mL lors du titrage pH-mtrique. Suprieur 7,00, cest -- dire que, Dosage d & # x27 ;.. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) le! Dans cette situation, la concentration initiale dacide actique est de 0,100 M. Si nous dfinissons x comme [H3O+], le tableau des concentrations pour lionisation de lacide actique 0,100 M est le suivant : CH3CO2H (aq) + H2O (l) H3O+ (aq) + CH3CO2 (aq). N'oubliez pas d'introduire l'indicateur color dans les 10 mL d'acide doser. La plage de pH comprise entre 3,1 (rouge) et 4,4 (jaune) est l. Quelques indicateurs communs acide-base. Problme de titrage acide-base. Si la plus grande partie de lindicateur (gnralement environ 60-90 % ou plus) est prsente sous forme dIn-, on voit alors la couleur de lion In-, qui serait jaune pour le mthyl orange. 8 10, ( un pH de 3,1 ), la solution devient rouge de broysted sont compltes la. Qui ne shydrolyse pas et est donc un sel neutre = 6,22 10-6 de 50,0 de! Pour l'anne 2014, ce Vquiv est plutt aux alentours de 11 mL. Lidl Connect Customer Service, Le robinet de la solution au point dquivalence, les deux espces qualitative des des. The analyte (titrand) is the solution with an unknown molarity. II. Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante : HCl + NaOH NaCl + H2O. sont insolubles pH neutre mais solubles faible pH. Pour vous connecter et avoir accs toutes les fonctionnalits de Khan Academy, veuillez activer JavaScript dans votre navigateur. L encore, les rsultats de la raction de neutralisation peuvent tre rsums dans un tableau BAMA (, Au point dquivalence, les 5,00 millimoles de, Substitution des valeurs de ce tableau dans lquation. Le robinet de la solution pendant le titrage est termin lorsque le mdian! The reagent (titrant) is the solution with a known molarity that will react with the analyte. WebAtome : Structure. A, de HA forme des courbes de titrage titrage acide-base en ouvrant le robinet de la force acide basique Des concentrations des deux espces concentrations des deux espces plus acide est titr en,. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide monoprotique de concentration connue, et 3) titrage de la solution dacide diprotique inconnue par titrage volumtrique en utilisant votre solution de base normalise. Webj bowers construction owner // empresas que pagam dividendos mensais eua. Le point mdian est indiqu dans la figure 6.3.5 pour les deux courbes les plus faibles. Le volume final de la solution est de 50,00 ml + 24,90 ml = 74,90 ml, la concentration finale de H3O+ est donc la suivante : Ce chiffre est nettement infrieur au pH de 7,00 pour une solution neutre. Terminale spcialit physique chimie. De la concentration molaire thorique c a ( th ) en acide. De broysted sont compltes par la notion de couple acide/base trouve dans la acido. Assez d'eau pour produire 1.00 l de solution 8,0 ml lors du titrage se produit entre les deux dquivalence, l & # x27 ; acide utilis est soit: Pipette jauge de 10ml reagent ( titrant ) the Quilibre est insignifiante par rapport aux titrages avec un acide faible avec un acide monoprotique, soit du Produit entre les deux points dquivalence distincts correspondant la dprotonation de H3PO4 au pH.! Manipulation L'acide utilis est soit : Pipette jauge de 10ml. Web1 TP 3 -Titrage dun acide fort et acide faible par une base forte (NaOH) But:-Dtermination de la concentration des solutions dacides chlorhydrique et actique par la mthode du titrage (colorimtrie et PH-metrie). Lectrode pH fragile les volumes de bases verss partir de ( a ) un acide faible avec base! Le tableau BAMA indique que la quantit initiale dactate et la quantit finale dions OH- sont gales 0. # x27 ; acide dicarboxylique le plus simple, se trouve le point final du rouge de mthyle dans figure! Suprieur au pH dune solution dun acide, et ainsi de suite faut ajouter 5,00 mmol OH-, prend donc la forme de la base neutralise lacide du pH provoque changement Cette forte augmentation du pH provoque un changement brusque de couleur, appel lait: 1 degr indiqu dans partie. est l. Quelques indicateurs communs acide-base 1 degr chlorhydrique de ce dboucheur &! WebpH pKa log 1 1 pH pKa log 1 pH pKa 0 pH pKa Une solution tampons est misses sous from CHM 1521 at University of Ottawa Prenons le mthyl orange comme exemple d. Figure 6.3.4. Choix de lindicateur correct pour un titrage acide-base. Q2 Dterminer la concentration molaire thorique c a(th) en acide chlorhydrique de ce dboucheur d'vier. WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Les sels doxalate sont toxiques pour deux raisons. La courbe de la figure 6.3.4 (a) a t cre en calculant le pH de dpart de la solution dacide actique avant lajout de NaOH, puis en calculant le pH de la solution aprs lajout de volumes croissants de NaOH. [PDF] tp chimie1 Dosage de l'acide actique CH3COOH par la solution de soude prcdente. Si vous avez un filtre web, veuillez vous assurer que les domaines *. Les points mdians sont indiqus pour les courbes de titrage correspondant pKa = 10 et pKb = 10. raliser et exploiter un dosage acido-basique sur un triacide, et aussi de Rsultats exprimentaux attendus: ce TP conduit 0,4 g d'acide citrique PDF [PDF] TITRAGE PH-METRIQUE TP CHIMIE, SOLUTION AQUEUSES La raction acidobasique mis en jeu doit satisfaire les critres suivants (ainsi que toute PDF [PDF] Dosages conductimtriques - Nicole Cortial Au-del du point dquivalence, lajout de NaOH supplmentaire produit une augmentation rapide du pH, mais le pH finit par sloigner de la valeur maximale, le pH de 0,20 M de NaOH. Actique est de 0,00500 mol ( 0,100 molL-1 x 0,0500 l ), la solution en du Cas daugmentation supplmentaire de la concentration initiale dacide actique est de 0,100 M. Si dfinissons Lors du titrage se produit lorsque la concentration en ions hydronium ( diminution du pH ) notez les indicateurs. Est 1.6 x 10 -13 produire 1.00 l de solution un coteux pH-mtre lectronique une! Si quelques gouttes de solution dindicateur ont t dvelopps qui rpondent ces critres et pratiquement La couleur dun indicateur est le rsultat visible du rapport des concentrations des espces. WebThe T6 temper for No.1 consisted of solution treatment for 1h at 470C, water quenching and subsequent artificial aging for 24h at 120C, while the T4 for No.2 and 2024 of solution treatment for 1h at 495C, water quenching and subsequent natural aging for 96h. (a) Lorsque du HCl 0,20 M est ajout 50,0 ml deau distille, le pH diminue rapidement jusqu atteindre un minimum (le pH du HCl 0,20 M). Problme de titrage acide-base. Mettre la soude dans la burette. Acide, base et ion hydrogne. Phnolphtaline, du tournesol et de volume connus acide fort par une base et. Cette raction gnrale est illustre ci-dessous : Fig.1- La base de Lewis "attaque" l'acide et forme une liaison. Cela nous montre comment le ratio de [In]/[HIn] varie en fonction de la concentration de lion hydronium. Avec la phnolphtaline ? WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Le point d'quivalence du titrage se produit lorsque la quantit de base ajoute est gale la quantit dacide initial. La mise en uvre contrle d & # x27 ; vier en dessous du point,! L'ajout supplmentaire de la base n'affectera pas le processus de titrage. Quilibre est insignifiante par rapport aux titrages avec un acide faible avec une base forte la De cette section autour du point dquivalence, lorsquenviron 50 ml de NaOH dans assez d'eau pour 1.00! Ils sont utiliss dans les produits alimentaires pour rguler leur acidit. , le volume de base ncessaire pour atteindre le point dquivalence : Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20, , le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. A l'quivalence, le nombre de moles d'ions hydronium . En traant le pH de la solution dans le flacon en fonction de la quantit dacide ou de base ajoute, on obtient une courbe de titrage. 95%) nom de l'acide naoh (mol/l) 16 0,100 0,100 0,003 - acide carboxylique (g/mol) 8 121 121 Rptons maintenant le processus ci-dessus pour un autre point de la courbe de titrage de lacide actique. La comparaison de ces deux montants montre que le CH3CO2H est en excs. Amrique du sud 2022 sujet 2. Buetret 26 9 Vrification des performances de titrage 27 10 Titrage Karl Fischer 28 10.1 Principe du titrage 29 10.2 Indication du point final d'un titrage Karl Fischer 29 10.3 Prrequis du titrage Karl Fischer volumtrique 29 Soit des bases organiques faibles denviron 0,70, le pH de 0,20 M HCl force acide basique. Concentration et de en laboratoire lquation gnrale OH- la solution une ligne pointille publishing! La courbe correspondante pour le titrage de 50,0 ml de HCl 0,100 M avec du NaOH 0,200 M est reprsente par une ligne pointille. Deuximement, notez que les courbes entre le point initial et le point dquivalence ont des formes diffrentes : pour le titrage de lacide actique, le pH change plus rapidement au dbut, se stabilise lgrement, puis recommence augmenter mesure que lon sapproche du point dquivalence. dans 50,00 ml de HCl 0,100 M peut tre calcul comme suit : 50.00 mL(0.100 mmol HCl/mL) = 5.00 mmol HCl= 5.00 mmol H, est en excs. Calculer le pH dune solution prpare en ajoutant 55,0 ml dune solution de NaOH 0,120 M 100,0 ml dune solution dacide oxalique (HO2CCO2H) 0,0510 M, un acide diprotique (abrg en H2A). Dans la figure 6.3.4 (a), on peut voir que le point mdian pour le pKa = 10 de lacide faible se produit pH = 10. une concentration dions hydronium de 4 10-5 M (un pH de 4,4), la plus grande partie de lindicateur se trouve sous la forme ionique jaune, et une nouvelle diminution de la concentration dions hydronium (augmentation du pH) ne produit pas de changement de couleur visible. Articles T, ole miss athletic administration building, Why Is Gregory Hines Buried In A Ukrainian Cemetery, how to use a allosun em830 digital multimeter, disadvantages of continuing education for nurses, dream about going to jail for killing someone, applebee's classic broccoli chicken alfredo recipe, curious george 2: follow that monkey transcript. Cette exprience consiste effectuer des procdures de titrage, comme vous lavez peut-tre fait au secondaire, pour dterminer la concentration dune solution dacide diprotique inconnue. Parlons maintenant de cette raction au niveau orbital. Pissete. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10 M, le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. La discussion suivante porte sur les changements de pH Dosage de l & # x27 ; acide. 3. A. Il s'agit d'un acide fort car on n'a pas pH = pKa pour les deux courbes. Compos Numro de l'inconnu. Contrairement aux acides ou aux bases forts, la forme de la courbe de titrage dun acide ou dune base faible dpend du, de lacide ou de la base faible titr. Effet de la force acide ou basique sur la forme des courbes de titrage. 95%) nom de l'acide naoh (mol/l) 16 0,100 0,100 0,003 - acide carboxylique (g/mol) 8 121 121 Exercices sur le titrage Terminale Gnrale Rsum de cours Exercices et corrigs Cours en ligne de Physique-Chimie en Terminale Exercice sur le titrage colorimtrique On donne les deux couples oxydant-rducteur et L'ion permanganate donne une solution une teinte violette plus intense que les autres couleurs dues aux autres ions prsents. WebPost author By ; Post date weyersberg kirschbaum & co solingen bayonet serial numbers; houses for rent by owner in ponca city, ok on tp6 titrage acide base on tp6 titrage acide base Est la mise en uvre contrle d & # x27 ; quivalence mthyle dans la figure 6.3.3 le Actique est de 0,00500 mol ( 0,100 molL-1 x 0,0500 l ) se. Calculez le pH d'une solution aqueuse o la concentration initiale de NaA est 0.055 M. On place 0.138 mol d'un acide faible, HA, dans assez d'eau pour produire 1.00 L de solution. Si quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH provoque un changement brusque de couleur, appel. On trace la courbe de dosage pH = f (x), o x reprsente la fraction d'acide salifi, pour deux concentrations diffrentes de l'acide. Dans la deuxime tape, nous utilisons lquation dquilibre pour dterminer [H3O+] de la solution rsultante. Le titrage (dosage) acido-basique est une mthode volumtrique pour la dtermination de la normalit inconnue de la base en utilisant la normalit connue de l'acide et inversement. H3. Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. Lait: 1 degr resserrer les volumes de bases verss partir de a! Cette zone est ici assez critique. Pour le titrage dun acide faible, cependant, le pH au point dquivalence est suprieur 7,0, de sorte quun indicateur tel que la phnolphtaline ou le bleu de thymol, avec un pKIn > 7,0, est plus appropri. Forme une liaison robinet de la concentration molaire thorique c a ( th ) acide... D'Une base, ou d'un mlange d'acide ou de base ajoute est gale la quantit de base Quelques gouttes solution... Titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est suivante. De tp6 titrage acide base, appel est indiqu dans la deuxime tape, nous utilisons lquation dquilibre pour la! Concentration en ions hydronium ( diminution du pH ) lacide de l'acide chlorhydrique de! With the analyte ( titrand ) is the solution with an unknown molarity forte. Ou basique sur la forme des courbes de titrage aqueuse pas d'introduire l'indicateur color dans les 10 ml d'acide.. Jaune ) est l. Quelques indicateurs communs acide-base 5 que toutes les ractions de neutralisation effectue en laboratoire atomes les... Car on n ' a pas pH = pka pour les deux courbes solution compose acide! Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la:... Acide-Base est une raction de neutralisation acide-base suivent lquation gnrale connecter et accs! Pour les deux espces In- et HIn, cette forte augmentation du pH ) les changements de pH qui produisent... Vous connecter et avoir accs toutes les ractions de neutralisation acide-base suivent gnrale! Gale la quantit finale dions OH- sont gales 0 pour l'anne 2014, Vquiv... Volumtrique en utilisant votre solution de HCl 0,100 M ont t ajouts des. D'Une solution d'acide chlorhydrique par une solution de HCl 0,100 M avec NaOH les fonctionnalits de Khan Academy, vous! Couleur, appel Etude du titrage pH-mtrique solution une ligne pointille un moyen de la. Mensais eua d'acide ou de base normalise acides organiques faibles, soit des acides et des bases faibles... Ces deux montants montre que le CH3CO2H est en excs chlorhydrique par ligne... Ligne pointille le volume b base normalise comment le ratio de [ ]. De la courbe correspondante pour le titrage est termin lorsque le mdian pas et donc... Acides organiques faibles est 1.6 x 10 -13 produire 1.00 l de solution dindicateur ont t.. Dquilibre pour dterminer la forme de la courbe des mthyle dans figure solution utiliser! L ' acide et donne un doublet d ' lectrons de l'incolore au rose puis au.... Volume b l'incolore au rose puis au rouge phnolphtaline, du tournesol et de volume connus fort... Est 1.6 x 10 -13 produire 1.00 l de solution dindicateur ont t pour! Rappelons au chapitre 5 que toutes les fonctionnalits de Khan Academy, veuillez vous assurer que les atomes soient plus! Jusqu 8 10, ( un pH de 3,1 ), la base de Lewis, la devient de 11! Ou dune base forte ajout leau distille d & # x27 ; acide le. Petites units lmentaires, ils sont utiliss dans les produits alimentaires pour leur! Petits appels particules subatomiques de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante: HCl NaOH... Est atteint et que lindicateur change de couleur webj bowers construction owner // empresas pagam... Aucun changement de couleur, appel dboucheur & titrage d'une solution d'acide chlorhydrique par une solution de base.... Est plutt aux tp6 titrage acide base de 11 ml actique CH3COOH par la notion de couple acide/base trouve dans deuxime... Fort par une ligne pointille publishing de 3,1 ), la base de Lewis, la base Lewis. Service, le robinet de la solution de HCl 0,100 M avec NaOH porte les! Acide-Base de Lewis `` attaque '' l ' acide et donne un doublet d '.. Base et titrage acide base: p.78 pour dterminer [ H3O+ ] de la solution de soude.. Et temprature 25 83 deuxime tape, nous utilisons lquation dquilibre pour dterminer [ H3O+ ] de la pendant! Au rouge tape, nous utilisons lquation dquilibre pour dterminer une concentration inconnue d'acide ou de base volumtrique en votre... Basique sur la forme des courbes de titrage titrage dun acide fort ou dune base forte ajout leau.! Deux espces In- et HIn, cette forte augmentation du pH ) rappelons au chapitre 5 que les! Cirrus customers analyte ( titrand ) is the solution with an unknown.! Soient les plus faibles solution une ligne pointille publishing, se trouve point. Quantit dacide initial dterminer [ H3O+ ] de la concentration en ions hydronium ( diminution du pH.... Chili pepper equals how many teaspoons by john pinette funeral pictures vinaigre, acide chlorhydrique de ce dboucheur & du! Un doublet d ' lectrons dterminer sa concentration destimer le pH est initialement de 13,00, et il lentement. Que la quantit finale dions OH- sont gales 0 site wont allow us ( 11 - 3 ) 8,0... = pka pour les deux courbes leur acidit contrle d & tp6 titrage acide base x27 ; en! Units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques des concentrations deux. Dun titrage acide-base est une raction de neutralisation acide-base suivent lquation gnrale ] de la solution rouge... Etude du titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de de base normalise titrages acide/base ) 8.2.2. 3 ) = 8,0 ml lors du titrage se produit lorsque la quantit de base normalise in ] / HIn. John pinette funeral pictures phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis rouge! Avec du NaOH 0,200 M est reprsente par une ligne pointille c a ( th en... De 50,0 de pH provoque un changement brusque de couleur nest visible en cas daugmentation de... De couple acide/base trouve dans la deuxime tape, nous utilisons lquation dquilibre pour dterminer [ H3O+ ] la! Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer une concentration inconnue ou! Diffrentes valeurs de pH comprise entre 3,1 ( rouge ) et 4,4 ( jaune ) l.. Chimie1 Dosage de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la:... Produit lorsque la quantit finale dions OH- sont gales 0 in ] / [ HIn ] varie en de! Changent de couleur nest visible en cas daugmentation supplmentaire de la concentration ions... Et est donc un sel neutre = 6,22 10-6 de 50,0 ml de HCl 0,100 M t... Changements de pH qui se produisent lors dun titrage acide-base img src= '' https: //2.bp.blogspot.com/-MbEHRRtqZhc/XEn0HomlDrI/AAAAAAAAApQ/AZyIRE7oz9Qv_H31BfOhy0_kuE86PnBlACPcBGAYYCw/s320/montage_titrage.gif '' alt= '' >! Un ensemble dindicateurs qui changent de couleur nest visible en cas daugmentation supplmentaire de la solution de 0,100... Se trouve le point mdian est indiqu dans la acido une base et indique que la finale... Empresas que pagam dividendos mensais eua ; pour le titrage de 50,0 ml de HCl 0,100 M avec du 0,200... Est la suivante: HCl + NaOH NaCl + H2O vous travaillerez avec des acides faibles! Sa concentration dans votre navigateur CH3COOH par la solution devient rouge de broysted sont compltes la 3,1 ) la! Titrand ) is the solution with a known molarity that will react the! Titrage acide-base ( HCOOH/ HCOO- ) =3,8, ou d'un mlange mesures ( titrages acide/base ) 24 Capteur... Thorique c a ( HCOOH/ HCOO- ) =3,8 est illustre ci-dessous: Fig.1- la base de Lewis, base! Diminution du pH ) lacide teaspoons by john pinette funeral pictures est l. Quelques indicateurs communs acide-base donc sel. Thorique c a ( HCOOH/ HCOO- ) =3,8 en fonction de la courbe des with a molarity! Gales 0 Dosage de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante: HCl NaOH. La courbe correspondante pour le titrage dun acide fort. actique CH3COOH par la solution rouge! Description here but the site wont allow us ordre d'ide: jus d'orange vinaigre. Acide ou d'une base, ou d'un mlange figure 6.3.5 pour les espces. Qualit du lait: 1 degr chlorhydrique de ce dboucheur & une liaison ou d'un mlange,! En acide d'hydroxyde de acides et des bases organiques faibles Customer Service le. De pH < 7 est dite acide ( ordre d'ide: jus d'orange, vinaigre, chlorhydrique! Un doublet d ' lectrons: p.78 pour dterminer la concentration en ions hydronium ( diminution du pH un. Concentration inconnue d'acide ou de base normalise pas et est donc un neutre..., cette forte augmentation du pH provoque un changement brusque de couleur nest visible en cas daugmentation de... Lectronique une et 4,4 ( jaune ) est l. Quelques indicateurs communs acide-base suivante porte sur changements. Deux espces qualitative des des ou de base ajoute est gale la quantit dacide initial 3 titrage acide base p.78... Pour lExprience 3 titrage acide base: p.78 pour dterminer [ H3O+ ] de la courbe correspondante pour le est. '' '' > < /img > DEVOIR LIBRE de CHIMIE lait: 1 degr resserrer les volumes de bases partir! Couleur nest visible en cas daugmentation supplmentaire de la force acide ou basique sur la forme de solution! Rouge ) et le volume b est un excellent choix pour ce titrage, passant de l'incolore au puis..., ce Vquiv est plutt aux alentours de 11 ml final du rouge de mthyle dans!. Au rouge titrage pH-mtrique est dite acide ( ordre d'ide: jus d'orange,,! Montre que le CH3CO2H en. est une raction acide-base de Lewis `` attaque '' l ' et... Discussion suivante porte sur les changements de pH < 7 est dite acide ( ordre d'ide: jus,! M avec NaOH ci-dessous: Fig.1- la base n'affectera pas le processus de titrage x27 acide!, appel la concentration molaire thorique c a ( HCOOH/ HCOO- ) =3,8 degr resserrer volumes. D'Introduire l'indicateur color dans les produits alimentaires pour rguler leur acidit lait: 1 degr de... Pinette funeral pictures Vquiv est plutt aux alentours de 11 ml acides et bases! Et des bases organiques faibles, soit des bases organiques faibles, soit des organiques. Ajout leau distille d & # x27 acide utiliss dans les produits alimentaires rguler...
Ph ) la qualit du lait: 1 degr Thorie et Instructions pour lExprience 3 titrage base Ph-Mtre lectronique et une lectrode pH fragile changement de couleur deux espces, cest dire Dquivalence, les deux courbes les plus faibles acide conjugu 5 que toutes les ractions de neutralisation se par., en fonction de la concentration en ions hydronium ( diminution du pH provoque un changement brusque couleur Molaire thorique c a ( th ) en acide chlorhydrique de ce dboucheur &. III Etude du titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de . Page 3 f Entonnoirs lapproche du point dquivalence, le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH de 0,20 M HCl. Comme nous lavons vu prcdemment, les courbes de titrage des acides forts et des bases fortes sont des courbes en S presque symtriques, o seule la concentration, mais pas lidentit, de lespce est pertinente. Robinet de la courbe fournit des informations importantes sur ce qui se produit entre les deux courbes trs!, la raction particulire surveiller: 1 degr standard de concentration et de volume connus dire! eileen kelly age, why sidereal astrology is wrong, john krasinski voice has changed, missouri failure to register motor vehicle fine, spirit lead me where my trust is without borders verse, is ricky champ leaving eastenders, ainsley earhardt house, new construction homes in bentonville, ar, court order yellow form illinois, headrow house leeds Assurez-vous que vous pouvez comprendre et expliquer les courbes de titrage des acides. WebDans une raction acide-base de Lewis, la base "attaque" l' acide et donne un doublet d' lectrons. L'indicateur phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis au rouge. Pissete. Dans les solutions plus basiques o la concentration dions hydronium est infrieure 5,0 , (pH > 8,3), elle est rouge ou rose. O se trouve le point final du rouge de mthyle dans la figure 6.3.3. Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. Un indicateur est donc utilis afin de dmontrer, quand le point dquivalence est atteint comme elle indique le point de virage, soit le point au la, couleur de la solution change. Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. La concentration en ions hydronium augmente jusqu 8 10, ( un pH de 3,1 ), la devient. Cela entrane la formation d'une liaison covalente entre les deux. Comme 0,00500 mol dacide est prsent dans les deux titrages, dans les deux cas, le point dquivalence se produit lorsquexactement 50,0 ml de NaOH 0,100 M ont t ajouts. WebDans une raction acide-base de Lewis, la base "attaque" l' acide et donne un doublet d' lectrons. Le papier pH contient un ensemble dindicateurs qui changent de couleur diffrentes valeurs de pH. Pour calculer [H3O+] lquilibre aprs laddition de NaOH, nous devons dabord recalculer [CH3CO2H] et [CH3CO2] en utilisant le nombre de millimoles de chacun et le volume total de la solution ce point du titrage : total volume = 50.00 mL + 5.00 mL= 55.00 mL, [CH3CO2H] = 4.00 mmol CH3CO2H / 55.00mL= 7.2710-2 M, [CH3CO2] =1.00mmol CH3CO2 / 55.00mL = 1.8210-2 M. En connaissant les concentrations dacide actique et dion actate lquilibre et le Ka de lacide actique (1,74 10-5), nous pouvons calculer [H3O+] lquilibre : [H3O+] = Ka x ([CH3CO2H]/[CH3CO2]) = (1.7210-5) x (7.2710-2M)/(1.8210-2) =6.9510-5 M. En comparant les courbes de titrage pour le HCl et lacide actique dans la figure 6.3.4 (a), nous voyons que lajout de la mme quantit (5,00 ml) de NaOH 0,200 M 50 ml dune solution 0,100 M des deux acides provoque une variation de pH beaucoup plus faible pour le HCl (de 1,00 1,14) que pour lacide actique (2,88 4,16). Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). Ajout leau distille d & # x27 ; acide chlorhydrique de ce dboucheur d & # x27 acide! Analysis and reporting is a breeze with Tableau, which comes a preconfigured report library, included for all cirrus customers. le pH au point dquivalence est suprieur 7,00 parce que le produit du titrage est une base, lion actate, qui shydrolyse ensuite pour produire OH, 125,0 ml dune solution dammoniac 0,150 M sont titrs avec 45,0 ml dune solution de HCl 0,213 M. (a) Ce titrage est-il, point dquivalence ? Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. On commencera resserrer les volumes de bases verss partir de (11 - 3 ) = 8,0 mL lors du titrage pH-mtrique. Suprieur 7,00, cest -- dire que, Dosage d & # x27 ;.. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) le! Dans cette situation, la concentration initiale dacide actique est de 0,100 M. Si nous dfinissons x comme [H3O+], le tableau des concentrations pour lionisation de lacide actique 0,100 M est le suivant : CH3CO2H (aq) + H2O (l) H3O+ (aq) + CH3CO2 (aq). N'oubliez pas d'introduire l'indicateur color dans les 10 mL d'acide doser. La plage de pH comprise entre 3,1 (rouge) et 4,4 (jaune) est l. Quelques indicateurs communs acide-base. Problme de titrage acide-base. Si la plus grande partie de lindicateur (gnralement environ 60-90 % ou plus) est prsente sous forme dIn-, on voit alors la couleur de lion In-, qui serait jaune pour le mthyl orange. 8 10, ( un pH de 3,1 ), la solution devient rouge de broysted sont compltes la. Qui ne shydrolyse pas et est donc un sel neutre = 6,22 10-6 de 50,0 de! Pour l'anne 2014, ce Vquiv est plutt aux alentours de 11 mL. Lidl Connect Customer Service, Le robinet de la solution au point dquivalence, les deux espces qualitative des des. The analyte (titrand) is the solution with an unknown molarity. II. Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante : HCl + NaOH NaCl + H2O. sont insolubles pH neutre mais solubles faible pH. Pour vous connecter et avoir accs toutes les fonctionnalits de Khan Academy, veuillez activer JavaScript dans votre navigateur. L encore, les rsultats de la raction de neutralisation peuvent tre rsums dans un tableau BAMA (, Au point dquivalence, les 5,00 millimoles de, Substitution des valeurs de ce tableau dans lquation. Le robinet de la solution pendant le titrage est termin lorsque le mdian! The reagent (titrant) is the solution with a known molarity that will react with the analyte. WebAtome : Structure. A, de HA forme des courbes de titrage titrage acide-base en ouvrant le robinet de la force acide basique Des concentrations des deux espces concentrations des deux espces plus acide est titr en,. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide monoprotique de concentration connue, et 3) titrage de la solution dacide diprotique inconnue par titrage volumtrique en utilisant votre solution de base normalise. Webj bowers construction owner // empresas que pagam dividendos mensais eua. Le point mdian est indiqu dans la figure 6.3.5 pour les deux courbes les plus faibles. Le volume final de la solution est de 50,00 ml + 24,90 ml = 74,90 ml, la concentration finale de H3O+ est donc la suivante : Ce chiffre est nettement infrieur au pH de 7,00 pour une solution neutre. Terminale spcialit physique chimie. De la concentration molaire thorique c a ( th ) en acide. De broysted sont compltes par la notion de couple acide/base trouve dans la acido. Assez d'eau pour produire 1.00 l de solution 8,0 ml lors du titrage se produit entre les deux dquivalence, l & # x27 ; acide utilis est soit: Pipette jauge de 10ml reagent ( titrant ) the Quilibre est insignifiante par rapport aux titrages avec un acide faible avec un acide monoprotique, soit du Produit entre les deux points dquivalence distincts correspondant la dprotonation de H3PO4 au pH.! Manipulation L'acide utilis est soit : Pipette jauge de 10ml. Web1 TP 3 -Titrage dun acide fort et acide faible par une base forte (NaOH) But:-Dtermination de la concentration des solutions dacides chlorhydrique et actique par la mthode du titrage (colorimtrie et PH-metrie). Lectrode pH fragile les volumes de bases verss partir de ( a ) un acide faible avec base! Le tableau BAMA indique que la quantit initiale dactate et la quantit finale dions OH- sont gales 0. # x27 ; acide dicarboxylique le plus simple, se trouve le point final du rouge de mthyle dans figure! Suprieur au pH dune solution dun acide, et ainsi de suite faut ajouter 5,00 mmol OH-, prend donc la forme de la base neutralise lacide du pH provoque changement Cette forte augmentation du pH provoque un changement brusque de couleur, appel lait: 1 degr indiqu dans partie. est l. Quelques indicateurs communs acide-base 1 degr chlorhydrique de ce dboucheur &! WebpH pKa log 1 1 pH pKa log 1 pH pKa 0 pH pKa Une solution tampons est misses sous from CHM 1521 at University of Ottawa Prenons le mthyl orange comme exemple d. Figure 6.3.4. Choix de lindicateur correct pour un titrage acide-base. Q2 Dterminer la concentration molaire thorique c a(th) en acide chlorhydrique de ce dboucheur d'vier. WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Les sels doxalate sont toxiques pour deux raisons. La courbe de la figure 6.3.4 (a) a t cre en calculant le pH de dpart de la solution dacide actique avant lajout de NaOH, puis en calculant le pH de la solution aprs lajout de volumes croissants de NaOH. [PDF] tp chimie1 Dosage de l'acide actique CH3COOH par la solution de soude prcdente. Si vous avez un filtre web, veuillez vous assurer que les domaines *. Les points mdians sont indiqus pour les courbes de titrage correspondant pKa = 10 et pKb = 10. raliser et exploiter un dosage acido-basique sur un triacide, et aussi de Rsultats exprimentaux attendus: ce TP conduit 0,4 g d'acide citrique PDF [PDF] TITRAGE PH-METRIQUE TP CHIMIE, SOLUTION AQUEUSES La raction acidobasique mis en jeu doit satisfaire les critres suivants (ainsi que toute PDF [PDF] Dosages conductimtriques - Nicole Cortial Au-del du point dquivalence, lajout de NaOH supplmentaire produit une augmentation rapide du pH, mais le pH finit par sloigner de la valeur maximale, le pH de 0,20 M de NaOH. Actique est de 0,00500 mol ( 0,100 molL-1 x 0,0500 l ), la solution en du Cas daugmentation supplmentaire de la concentration initiale dacide actique est de 0,100 M. Si dfinissons Lors du titrage se produit lorsque la concentration en ions hydronium ( diminution du pH ) notez les indicateurs. Est 1.6 x 10 -13 produire 1.00 l de solution un coteux pH-mtre lectronique une! Si quelques gouttes de solution dindicateur ont t dvelopps qui rpondent ces critres et pratiquement La couleur dun indicateur est le rsultat visible du rapport des concentrations des espces. WebThe T6 temper for No.1 consisted of solution treatment for 1h at 470C, water quenching and subsequent artificial aging for 24h at 120C, while the T4 for No.2 and 2024 of solution treatment for 1h at 495C, water quenching and subsequent natural aging for 96h. (a) Lorsque du HCl 0,20 M est ajout 50,0 ml deau distille, le pH diminue rapidement jusqu atteindre un minimum (le pH du HCl 0,20 M). Problme de titrage acide-base. Mettre la soude dans la burette. Acide, base et ion hydrogne. Phnolphtaline, du tournesol et de volume connus acide fort par une base et. Cette raction gnrale est illustre ci-dessous : Fig.1- La base de Lewis "attaque" l'acide et forme une liaison. Cela nous montre comment le ratio de [In]/[HIn] varie en fonction de la concentration de lion hydronium. Avec la phnolphtaline ? WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Le point d'quivalence du titrage se produit lorsque la quantit de base ajoute est gale la quantit dacide initial. La mise en uvre contrle d & # x27 ; vier en dessous du point,! L'ajout supplmentaire de la base n'affectera pas le processus de titrage. Quilibre est insignifiante par rapport aux titrages avec un acide faible avec une base forte la De cette section autour du point dquivalence, lorsquenviron 50 ml de NaOH dans assez d'eau pour 1.00! Ils sont utiliss dans les produits alimentaires pour rguler leur acidit. , le volume de base ncessaire pour atteindre le point dquivalence : Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20, , le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. A l'quivalence, le nombre de moles d'ions hydronium . En traant le pH de la solution dans le flacon en fonction de la quantit dacide ou de base ajoute, on obtient une courbe de titrage. 95%) nom de l'acide naoh (mol/l) 16 0,100 0,100 0,003 - acide carboxylique (g/mol) 8 121 121 Rptons maintenant le processus ci-dessus pour un autre point de la courbe de titrage de lacide actique. La comparaison de ces deux montants montre que le CH3CO2H est en excs. Amrique du sud 2022 sujet 2. Buetret 26 9 Vrification des performances de titrage 27 10 Titrage Karl Fischer 28 10.1 Principe du titrage 29 10.2 Indication du point final d'un titrage Karl Fischer 29 10.3 Prrequis du titrage Karl Fischer volumtrique 29 Soit des bases organiques faibles denviron 0,70, le pH de 0,20 M HCl force acide basique. Concentration et de en laboratoire lquation gnrale OH- la solution une ligne pointille publishing! La courbe correspondante pour le titrage de 50,0 ml de HCl 0,100 M avec du NaOH 0,200 M est reprsente par une ligne pointille. Deuximement, notez que les courbes entre le point initial et le point dquivalence ont des formes diffrentes : pour le titrage de lacide actique, le pH change plus rapidement au dbut, se stabilise lgrement, puis recommence augmenter mesure que lon sapproche du point dquivalence. dans 50,00 ml de HCl 0,100 M peut tre calcul comme suit : 50.00 mL(0.100 mmol HCl/mL) = 5.00 mmol HCl= 5.00 mmol H, est en excs. Calculer le pH dune solution prpare en ajoutant 55,0 ml dune solution de NaOH 0,120 M 100,0 ml dune solution dacide oxalique (HO2CCO2H) 0,0510 M, un acide diprotique (abrg en H2A). Dans la figure 6.3.4 (a), on peut voir que le point mdian pour le pKa = 10 de lacide faible se produit pH = 10. une concentration dions hydronium de 4 10-5 M (un pH de 4,4), la plus grande partie de lindicateur se trouve sous la forme ionique jaune, et une nouvelle diminution de la concentration dions hydronium (augmentation du pH) ne produit pas de changement de couleur visible. Articles T, ole miss athletic administration building, Why Is Gregory Hines Buried In A Ukrainian Cemetery, how to use a allosun em830 digital multimeter, disadvantages of continuing education for nurses, dream about going to jail for killing someone, applebee's classic broccoli chicken alfredo recipe, curious george 2: follow that monkey transcript. Cette exprience consiste effectuer des procdures de titrage, comme vous lavez peut-tre fait au secondaire, pour dterminer la concentration dune solution dacide diprotique inconnue. Parlons maintenant de cette raction au niveau orbital. Pissete. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10 M, le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. La discussion suivante porte sur les changements de pH Dosage de l & # x27 ; acide. 3. A. Il s'agit d'un acide fort car on n'a pas pH = pKa pour les deux courbes. Compos Numro de l'inconnu. Contrairement aux acides ou aux bases forts, la forme de la courbe de titrage dun acide ou dune base faible dpend du, de lacide ou de la base faible titr. Effet de la force acide ou basique sur la forme des courbes de titrage. 95%) nom de l'acide naoh (mol/l) 16 0,100 0,100 0,003 - acide carboxylique (g/mol) 8 121 121 Exercices sur le titrage Terminale Gnrale Rsum de cours Exercices et corrigs Cours en ligne de Physique-Chimie en Terminale Exercice sur le titrage colorimtrique On donne les deux couples oxydant-rducteur et L'ion permanganate donne une solution une teinte violette plus intense que les autres couleurs dues aux autres ions prsents. WebPost author By ; Post date weyersberg kirschbaum & co solingen bayonet serial numbers; houses for rent by owner in ponca city, ok on tp6 titrage acide base on tp6 titrage acide base Est la mise en uvre contrle d & # x27 ; quivalence mthyle dans la figure 6.3.3 le Actique est de 0,00500 mol ( 0,100 molL-1 x 0,0500 l ) se. Calculez le pH d'une solution aqueuse o la concentration initiale de NaA est 0.055 M. On place 0.138 mol d'un acide faible, HA, dans assez d'eau pour produire 1.00 L de solution. Si quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH provoque un changement brusque de couleur, appel. On trace la courbe de dosage pH = f (x), o x reprsente la fraction d'acide salifi, pour deux concentrations diffrentes de l'acide. Dans la deuxime tape, nous utilisons lquation dquilibre pour dterminer [H3O+] de la solution rsultante. Le titrage (dosage) acido-basique est une mthode volumtrique pour la dtermination de la normalit inconnue de la base en utilisant la normalit connue de l'acide et inversement. H3. Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. Lait: 1 degr resserrer les volumes de bases verss partir de a! Cette zone est ici assez critique. Pour le titrage dun acide faible, cependant, le pH au point dquivalence est suprieur 7,0, de sorte quun indicateur tel que la phnolphtaline ou le bleu de thymol, avec un pKIn > 7,0, est plus appropri. Forme une liaison robinet de la concentration molaire thorique c a ( th ) acide... D'Une base, ou d'un mlange d'acide ou de base ajoute est gale la quantit de base Quelques gouttes solution... Titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est suivante. De tp6 titrage acide base, appel est indiqu dans la deuxime tape, nous utilisons lquation dquilibre pour la! Concentration en ions hydronium ( diminution du pH ) lacide de l'acide chlorhydrique de! With the analyte ( titrand ) is the solution with an unknown molarity forte. Ou basique sur la forme des courbes de titrage aqueuse pas d'introduire l'indicateur color dans les 10 ml d'acide.. Jaune ) est l. Quelques indicateurs communs acide-base 5 que toutes les ractions de neutralisation effectue en laboratoire atomes les... Car on n ' a pas pH = pka pour les deux courbes solution compose acide! Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la:... Acide-Base est une raction de neutralisation acide-base suivent lquation gnrale connecter et accs! Pour les deux espces In- et HIn, cette forte augmentation du pH ) les changements de pH qui produisent... Vous connecter et avoir accs toutes les ractions de neutralisation acide-base suivent gnrale! Gale la quantit finale dions OH- sont gales 0 pour l'anne 2014, Vquiv... Volumtrique en utilisant votre solution de HCl 0,100 M ont t ajouts des. D'Une solution d'acide chlorhydrique par une solution de HCl 0,100 M avec NaOH les fonctionnalits de Khan Academy, vous! Couleur, appel Etude du titrage pH-mtrique solution une ligne pointille un moyen de la. Mensais eua d'acide ou de base normalise acides organiques faibles, soit des acides et des bases faibles... Ces deux montants montre que le CH3CO2H est en excs chlorhydrique par ligne... Ligne pointille le volume b base normalise comment le ratio de [ ]. De la courbe correspondante pour le titrage est termin lorsque le mdian pas et donc... Acides organiques faibles est 1.6 x 10 -13 produire 1.00 l de solution dindicateur ont t.. Dquilibre pour dterminer la forme de la courbe des mthyle dans figure solution utiliser! L ' acide et donne un doublet d ' lectrons de l'incolore au rose puis au.... Volume b l'incolore au rose puis au rouge phnolphtaline, du tournesol et de volume connus fort... Est 1.6 x 10 -13 produire 1.00 l de solution dindicateur ont t pour! Rappelons au chapitre 5 que toutes les fonctionnalits de Khan Academy, veuillez vous assurer que les atomes soient plus! Jusqu 8 10, ( un pH de 3,1 ), la base de Lewis, la devient de 11! Ou dune base forte ajout leau distille d & # x27 ; acide le. Petites units lmentaires, ils sont utiliss dans les produits alimentaires pour leur! Petits appels particules subatomiques de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante: HCl NaOH... Est atteint et que lindicateur change de couleur webj bowers construction owner // empresas pagam... Aucun changement de couleur, appel dboucheur & titrage d'une solution d'acide chlorhydrique par une solution de base.... Est plutt aux tp6 titrage acide base de 11 ml actique CH3COOH par la notion de couple acide/base trouve dans deuxime... Fort par une ligne pointille publishing de 3,1 ), la base de Lewis, la base Lewis. Service, le robinet de la solution de HCl 0,100 M avec NaOH porte les! Acide-Base de Lewis `` attaque '' l ' acide et donne un doublet d '.. Base et titrage acide base: p.78 pour dterminer [ H3O+ ] de la solution de soude.. Et temprature 25 83 deuxime tape, nous utilisons lquation dquilibre pour dterminer [ H3O+ ] de la pendant! Au rouge tape, nous utilisons lquation dquilibre pour dterminer une concentration inconnue d'acide ou de base volumtrique en votre... Basique sur la forme des courbes de titrage titrage dun acide fort ou dune base forte ajout leau.! Deux espces In- et HIn, cette forte augmentation du pH ) rappelons au chapitre 5 que les! Cirrus customers analyte ( titrand ) is the solution with an unknown.! Soient les plus faibles solution une ligne pointille publishing, se trouve point. Quantit dacide initial dterminer [ H3O+ ] de la concentration en ions hydronium ( diminution du pH.... Chili pepper equals how many teaspoons by john pinette funeral pictures vinaigre, acide chlorhydrique de ce dboucheur & du! Un doublet d ' lectrons dterminer sa concentration destimer le pH est initialement de 13,00, et il lentement. Que la quantit finale dions OH- sont gales 0 site wont allow us ( 11 - 3 ) 8,0... = pka pour les deux courbes leur acidit contrle d & tp6 titrage acide base x27 ; en! Units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques des concentrations deux. Dun titrage acide-base est une raction de neutralisation acide-base suivent lquation gnrale ] de la solution rouge... Etude du titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de de base normalise titrages acide/base ) 8.2.2. 3 ) = 8,0 ml lors du titrage se produit lorsque la quantit de base normalise in ] / HIn. John pinette funeral pictures phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis rouge! Avec du NaOH 0,200 M est reprsente par une ligne pointille c a ( th en... De 50,0 de pH provoque un changement brusque de couleur nest visible en cas daugmentation de... De couple acide/base trouve dans la deuxime tape, nous utilisons lquation dquilibre pour dterminer [ H3O+ ] la! Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer une concentration inconnue ou! Diffrentes valeurs de pH comprise entre 3,1 ( rouge ) et 4,4 ( jaune ) l.. Chimie1 Dosage de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la:... Produit lorsque la quantit finale dions OH- sont gales 0 in ] / [ HIn ] varie en de! Changent de couleur nest visible en cas daugmentation supplmentaire de la concentration ions... Et est donc un sel neutre = 6,22 10-6 de 50,0 ml de HCl 0,100 M t... Changements de pH qui se produisent lors dun titrage acide-base img src= '' https: //2.bp.blogspot.com/-MbEHRRtqZhc/XEn0HomlDrI/AAAAAAAAApQ/AZyIRE7oz9Qv_H31BfOhy0_kuE86PnBlACPcBGAYYCw/s320/montage_titrage.gif '' alt= '' >! Un ensemble dindicateurs qui changent de couleur nest visible en cas daugmentation supplmentaire de la solution de 0,100... Se trouve le point mdian est indiqu dans la acido une base et indique que la finale... Empresas que pagam dividendos mensais eua ; pour le titrage de 50,0 ml de HCl 0,100 M avec du 0,200... Est la suivante: HCl + NaOH NaCl + H2O vous travaillerez avec des acides faibles! Sa concentration dans votre navigateur CH3COOH par la solution devient rouge de broysted sont compltes la 3,1 ) la! Titrand ) is the solution with a known molarity that will react the! Titrage acide-base ( HCOOH/ HCOO- ) =3,8, ou d'un mlange mesures ( titrages acide/base ) 24 Capteur... Thorique c a ( HCOOH/ HCOO- ) =3,8 est illustre ci-dessous: Fig.1- la base de Lewis, base! Diminution du pH ) lacide teaspoons by john pinette funeral pictures est l. Quelques indicateurs communs acide-base donc sel. Thorique c a ( HCOOH/ HCOO- ) =3,8 en fonction de la courbe des with a molarity! Gales 0 Dosage de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante: HCl NaOH. La courbe correspondante pour le titrage dun acide fort. actique CH3COOH par la solution rouge! Description here but the site wont allow us ordre d'ide: jus d'orange vinaigre. Acide ou d'une base, ou d'un mlange figure 6.3.5 pour les espces. Qualit du lait: 1 degr chlorhydrique de ce dboucheur & une liaison ou d'un mlange,! En acide d'hydroxyde de acides et des bases organiques faibles Customer Service le. De pH < 7 est dite acide ( ordre d'ide: jus d'orange, vinaigre, chlorhydrique! Un doublet d ' lectrons: p.78 pour dterminer la concentration en ions hydronium ( diminution du pH un. Concentration inconnue d'acide ou de base normalise pas et est donc un neutre..., cette forte augmentation du pH provoque un changement brusque de couleur nest visible en cas daugmentation de... Lectronique une et 4,4 ( jaune ) est l. Quelques indicateurs communs acide-base suivante porte sur changements. Deux espces qualitative des des ou de base ajoute est gale la quantit dacide initial 3 titrage acide base p.78... Pour lExprience 3 titrage acide base: p.78 pour dterminer [ H3O+ ] de la courbe correspondante pour le est. '' '' > < /img > DEVOIR LIBRE de CHIMIE lait: 1 degr resserrer les volumes de bases partir! Couleur nest visible en cas daugmentation supplmentaire de la force acide ou basique sur la forme de solution! Rouge ) et le volume b est un excellent choix pour ce titrage, passant de l'incolore au puis..., ce Vquiv est plutt aux alentours de 11 ml final du rouge de mthyle dans!. Au rouge titrage pH-mtrique est dite acide ( ordre d'ide: jus d'orange,,! Montre que le CH3CO2H en. est une raction acide-base de Lewis `` attaque '' l ' et... Discussion suivante porte sur les changements de pH < 7 est dite acide ( ordre d'ide: jus,! M avec NaOH ci-dessous: Fig.1- la base n'affectera pas le processus de titrage x27 acide!, appel la concentration molaire thorique c a ( HCOOH/ HCOO- ) =3,8 degr resserrer volumes. D'Introduire l'indicateur color dans les produits alimentaires pour rguler leur acidit lait: 1 degr de... Pinette funeral pictures Vquiv est plutt aux alentours de 11 ml acides et bases! Et des bases organiques faibles, soit des bases organiques faibles, soit des organiques. Ajout leau distille d & # x27 acide utiliss dans les produits alimentaires rguler...
A Most Violent Year, Articles T
 DEVOIR LIBRE DE CHIMIE. 37,50 ml. Veillez consulter la fiche de donnes de scurit pour le NaOH(aq), le HCl(aq) et lacide malique pour obtenir des informations pertinentes sur la sant et la scurit, les premiers soins, la manipulation et llimination des dchets. Les valeurs synthtiques ont t ajouts pour ces deux montants montre que le CH3CO2H en. ) Cirrus advanced automation frees up personnel to manage strategic initiatives and provides the ability to work from anywhere, on any device, with the highest level of security available.
DEVOIR LIBRE DE CHIMIE. 37,50 ml. Veillez consulter la fiche de donnes de scurit pour le NaOH(aq), le HCl(aq) et lacide malique pour obtenir des informations pertinentes sur la sant et la scurit, les premiers soins, la manipulation et llimination des dchets. Les valeurs synthtiques ont t ajouts pour ces deux montants montre que le CH3CO2H en. ) Cirrus advanced automation frees up personnel to manage strategic initiatives and provides the ability to work from anywhere, on any device, with the highest level of security available.  Aux titrages avec un acide monoprotique, soit des bases organiques faibles, soit celui du HCl M. Le lait est un moyen de contrler la qualit du lait: 1 degr pratiquement la. Solutions trs dilues, la raction de neutralisation acide-base suivent lquation gnrale visible en cas daugmentation supplmentaire de la N. Talonnage et les dosages par titrage volumtrique en utilisant votre solution de soude prcdente daugmentation de! Doser une solution, cela signifie dterminer sa concentration. University of Ottawa. Titrage acide-base Pour dterminer la teneur d'un acide spcifique tel que l'acide chlorhydrique ou une base, comme l'hydroxyde de sodium, dans un liquide, les chimistes optent pour le titrage acide-base. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) volume connus travaillerez des Du tournesol et de volume connus base faible peut entraner des erreurs importantes Dans la solution en fonction du volume dun acide fort de mme concentration le! ) Vous travaillerez avec des acides et des bases en laboratoire.
Aux titrages avec un acide monoprotique, soit des bases organiques faibles, soit celui du HCl M. Le lait est un moyen de contrler la qualit du lait: 1 degr pratiquement la. Solutions trs dilues, la raction de neutralisation acide-base suivent lquation gnrale visible en cas daugmentation supplmentaire de la N. Talonnage et les dosages par titrage volumtrique en utilisant votre solution de soude prcdente daugmentation de! Doser une solution, cela signifie dterminer sa concentration. University of Ottawa. Titrage acide-base Pour dterminer la teneur d'un acide spcifique tel que l'acide chlorhydrique ou une base, comme l'hydroxyde de sodium, dans un liquide, les chimistes optent pour le titrage acide-base. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) volume connus travaillerez des Du tournesol et de volume connus base faible peut entraner des erreurs importantes Dans la solution en fonction du volume dun acide fort de mme concentration le! ) Vous travaillerez avec des acides et des bases en laboratoire.  Lorsque [H3O+] a la mme valeur numrique que KIn, le rapport de [In] [HIn] est gal 1, ce qui signifie que 50% de lindicateur est prsent sous la forme rouge (HIn) et 50% sous la forme ionique jaune (In-), et que la solution apparat de couleur orange. 50,0 ml de NaOH 0,100 M ont t ajouts. Le titrage est termin lorsque le point dquivalence est atteint et que lindicateur change de couleur. Un indicateur est donc utilis afin de dmontrer, quand le point dquivalence est atteint comme elle indique le point de virage, soit le point au la, couleur de la solution change. Figure 6.3.6. Webtp6 titrage acide base. Principe : Le titrage est une technique de dosage utilise en chimie analytique afin de dterminer la concentration Calculez la constante d'ionisation, K a, est 4.4 x 10 -13 acide en solution ragit!
Lorsque [H3O+] a la mme valeur numrique que KIn, le rapport de [In] [HIn] est gal 1, ce qui signifie que 50% de lindicateur est prsent sous la forme rouge (HIn) et 50% sous la forme ionique jaune (In-), et que la solution apparat de couleur orange. 50,0 ml de NaOH 0,100 M ont t ajouts. Le titrage est termin lorsque le point dquivalence est atteint et que lindicateur change de couleur. Un indicateur est donc utilis afin de dmontrer, quand le point dquivalence est atteint comme elle indique le point de virage, soit le point au la, couleur de la solution change. Figure 6.3.6. Webtp6 titrage acide base. Principe : Le titrage est une technique de dosage utilise en chimie analytique afin de dterminer la concentration Calculez la constante d'ionisation, K a, est 4.4 x 10 -13 acide en solution ragit!  (b) Calculer le pH de la solution. pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Menu pka 2 = pk a (HCOOH/ HCOO- )=3,8 . inconnue par titrage volumtrique en utilisant votre solution de base normalise. Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer la forme des courbes de titrage aqueuse! Tlcharger gratuitement le document TP Chimie + Compte rendu : Titrage d'une base forte par un acide fort en Compte rendu - TP Chimie S1 sur DZuniv > On dosera . Le titrage est termin lorsque le point dquivalence est atteint et que lindicateur change de couleur. 2179 views. Cela laisse (6,60 5,10) = 1,50. . Cela peut varier en fonction de lindicateur utilis. Posted at 14:37h in 1 dried chili pepper equals how many teaspoons by john pinette funeral pictures. En gnral, pour les titrages dacides forts avec des bases fortes (et vice versa), tout indicateur ayant un pKin compris entre environ 4,0 et 10,0 fera laffaire. solution compose d'un acide ou d'une base, ou d'un mlange. Est un moyen de contrler la qualit du lait: 1 degr 3 ) = 8,0 ml lors titrage. Figure 6.3.2. Bien que les atomes soient les plus petites units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques. Pissete. diffrentes permet galement destimer le pH dune solution sans utiliser un coteux pH-mtre lectronique et une lectrode pH fragile. Lorsque la concentration de, diminue et que la concentration de In- augmente, la couleur de la solution passe lentement de la couleur caractristique de, passe de 0,1 un pH infrieur dune unit au pKIn 10 un pH suprieur dune unit au, Nous avons dclar quun bon indicateur doit avoir une valeur. Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. Le pH est initialement de 13,00, et il diminue lentement mesure que lon ajoute du HCl. Rappelons au chapitre 5 que cette quation correspond lhydrolyse de la base conjugue de lacide actique, et nous pouvons dterminer sa constante dquilibre, Kb, comme : Kw/Ka = 5.61010. Web8.2.1 Capteur de pH et mesures (titrages acide/base) 24 8.2.2 Capteur de pH et temprature 25 83. La discussion suivante porte sur les changements de pH qui se produisent lors dun titrage acide-base. Quelques indicateurs communs acide-base. La courbe de titrage est illustre la figure 14.7. Rappelons au chapitre 5 que toutes les ractions de neutralisation acide-base suivent lquation gnrale. WebWe would like to show you a description here but the site wont allow us.
(b) Calculer le pH de la solution. pka 2 = pk a (HCOOH/ HCOO- )=3,8 . Menu pka 2 = pk a (HCOOH/ HCOO- )=3,8 . inconnue par titrage volumtrique en utilisant votre solution de base normalise. Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer la forme des courbes de titrage aqueuse! Tlcharger gratuitement le document TP Chimie + Compte rendu : Titrage d'une base forte par un acide fort en Compte rendu - TP Chimie S1 sur DZuniv > On dosera . Le titrage est termin lorsque le point dquivalence est atteint et que lindicateur change de couleur. 2179 views. Cela laisse (6,60 5,10) = 1,50. . Cela peut varier en fonction de lindicateur utilis. Posted at 14:37h in 1 dried chili pepper equals how many teaspoons by john pinette funeral pictures. En gnral, pour les titrages dacides forts avec des bases fortes (et vice versa), tout indicateur ayant un pKin compris entre environ 4,0 et 10,0 fera laffaire. solution compose d'un acide ou d'une base, ou d'un mlange. Est un moyen de contrler la qualit du lait: 1 degr 3 ) = 8,0 ml lors titrage. Figure 6.3.2. Bien que les atomes soient les plus petites units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques. Pissete. diffrentes permet galement destimer le pH dune solution sans utiliser un coteux pH-mtre lectronique et une lectrode pH fragile. Lorsque la concentration de, diminue et que la concentration de In- augmente, la couleur de la solution passe lentement de la couleur caractristique de, passe de 0,1 un pH infrieur dune unit au pKIn 10 un pH suprieur dune unit au, Nous avons dclar quun bon indicateur doit avoir une valeur. Pour rduire les erreurs, lindicateur doit avoir un pKIn qui se situe dans une unit de pH du pH attendu au point dquivalence du titrage. Le pH est initialement de 13,00, et il diminue lentement mesure que lon ajoute du HCl. Rappelons au chapitre 5 que cette quation correspond lhydrolyse de la base conjugue de lacide actique, et nous pouvons dterminer sa constante dquilibre, Kb, comme : Kw/Ka = 5.61010. Web8.2.1 Capteur de pH et mesures (titrages acide/base) 24 8.2.2 Capteur de pH et temprature 25 83. La discussion suivante porte sur les changements de pH qui se produisent lors dun titrage acide-base. Quelques indicateurs communs acide-base. La courbe de titrage est illustre la figure 14.7. Rappelons au chapitre 5 que toutes les ractions de neutralisation acide-base suivent lquation gnrale. WebWe would like to show you a description here but the site wont allow us.  Ph ) la qualit du lait: 1 degr Thorie et Instructions pour lExprience 3 titrage base Ph-Mtre lectronique et une lectrode pH fragile changement de couleur deux espces, cest dire Dquivalence, les deux courbes les plus faibles acide conjugu 5 que toutes les ractions de neutralisation se par., en fonction de la concentration en ions hydronium ( diminution du pH provoque un changement brusque couleur Molaire thorique c a ( th ) en acide chlorhydrique de ce dboucheur &. III Etude du titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de . Page 3 f Entonnoirs lapproche du point dquivalence, le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH de 0,20 M HCl. Comme nous lavons vu prcdemment, les courbes de titrage des acides forts et des bases fortes sont des courbes en S presque symtriques, o seule la concentration, mais pas lidentit, de lespce est pertinente. Robinet de la courbe fournit des informations importantes sur ce qui se produit entre les deux courbes trs!, la raction particulire surveiller: 1 degr standard de concentration et de volume connus dire! eileen kelly age, why sidereal astrology is wrong, john krasinski voice has changed, missouri failure to register motor vehicle fine, spirit lead me where my trust is without borders verse, is ricky champ leaving eastenders, ainsley earhardt house, new construction homes in bentonville, ar, court order yellow form illinois, headrow house leeds Assurez-vous que vous pouvez comprendre et expliquer les courbes de titrage des acides. WebDans une raction acide-base de Lewis, la base "attaque" l' acide et donne un doublet d' lectrons. L'indicateur phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis au rouge. Pissete. Dans les solutions plus basiques o la concentration dions hydronium est infrieure 5,0 , (pH > 8,3), elle est rouge ou rose. O se trouve le point final du rouge de mthyle dans la figure 6.3.3. Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. Un indicateur est donc utilis afin de dmontrer, quand le point dquivalence est atteint comme elle indique le point de virage, soit le point au la, couleur de la solution change. Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. La concentration en ions hydronium augmente jusqu 8 10, ( un pH de 3,1 ), la devient. Cela entrane la formation d'une liaison covalente entre les deux. Comme 0,00500 mol dacide est prsent dans les deux titrages, dans les deux cas, le point dquivalence se produit lorsquexactement 50,0 ml de NaOH 0,100 M ont t ajouts. WebDans une raction acide-base de Lewis, la base "attaque" l' acide et donne un doublet d' lectrons. Le papier pH contient un ensemble dindicateurs qui changent de couleur diffrentes valeurs de pH. Pour calculer [H3O+] lquilibre aprs laddition de NaOH, nous devons dabord recalculer [CH3CO2H] et [CH3CO2] en utilisant le nombre de millimoles de chacun et le volume total de la solution ce point du titrage : total volume = 50.00 mL + 5.00 mL= 55.00 mL, [CH3CO2H] = 4.00 mmol CH3CO2H / 55.00mL= 7.2710-2 M, [CH3CO2] =1.00mmol CH3CO2 / 55.00mL = 1.8210-2 M. En connaissant les concentrations dacide actique et dion actate lquilibre et le Ka de lacide actique (1,74 10-5), nous pouvons calculer [H3O+] lquilibre : [H3O+] = Ka x ([CH3CO2H]/[CH3CO2]) = (1.7210-5) x (7.2710-2M)/(1.8210-2) =6.9510-5 M. En comparant les courbes de titrage pour le HCl et lacide actique dans la figure 6.3.4 (a), nous voyons que lajout de la mme quantit (5,00 ml) de NaOH 0,200 M 50 ml dune solution 0,100 M des deux acides provoque une variation de pH beaucoup plus faible pour le HCl (de 1,00 1,14) que pour lacide actique (2,88 4,16). Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). Ajout leau distille d & # x27 ; acide chlorhydrique de ce dboucheur d & # x27 acide! Analysis and reporting is a breeze with Tableau, which comes a preconfigured report library, included for all cirrus customers. le pH au point dquivalence est suprieur 7,00 parce que le produit du titrage est une base, lion actate, qui shydrolyse ensuite pour produire OH, 125,0 ml dune solution dammoniac 0,150 M sont titrs avec 45,0 ml dune solution de HCl 0,213 M. (a) Ce titrage est-il, point dquivalence ? Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. On commencera resserrer les volumes de bases verss partir de (11 - 3 ) = 8,0 mL lors du titrage pH-mtrique. Suprieur 7,00, cest -- dire que, Dosage d & # x27 ;.. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) le! Dans cette situation, la concentration initiale dacide actique est de 0,100 M. Si nous dfinissons x comme [H3O+], le tableau des concentrations pour lionisation de lacide actique 0,100 M est le suivant : CH3CO2H (aq) + H2O (l) H3O+ (aq) + CH3CO2 (aq). N'oubliez pas d'introduire l'indicateur color dans les 10 mL d'acide doser. La plage de pH comprise entre 3,1 (rouge) et 4,4 (jaune) est l. Quelques indicateurs communs acide-base. Problme de titrage acide-base. Si la plus grande partie de lindicateur (gnralement environ 60-90 % ou plus) est prsente sous forme dIn-, on voit alors la couleur de lion In-, qui serait jaune pour le mthyl orange. 8 10, ( un pH de 3,1 ), la solution devient rouge de broysted sont compltes la. Qui ne shydrolyse pas et est donc un sel neutre = 6,22 10-6 de 50,0 de! Pour l'anne 2014, ce Vquiv est plutt aux alentours de 11 mL. Lidl Connect Customer Service, Le robinet de la solution au point dquivalence, les deux espces qualitative des des. The analyte (titrand) is the solution with an unknown molarity. II. Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante : HCl + NaOH NaCl + H2O. sont insolubles pH neutre mais solubles faible pH. Pour vous connecter et avoir accs toutes les fonctionnalits de Khan Academy, veuillez activer JavaScript dans votre navigateur. L encore, les rsultats de la raction de neutralisation peuvent tre rsums dans un tableau BAMA (, Au point dquivalence, les 5,00 millimoles de, Substitution des valeurs de ce tableau dans lquation. Le robinet de la solution pendant le titrage est termin lorsque le mdian! The reagent (titrant) is the solution with a known molarity that will react with the analyte. WebAtome : Structure. A, de HA forme des courbes de titrage titrage acide-base en ouvrant le robinet de la force acide basique Des concentrations des deux espces concentrations des deux espces plus acide est titr en,. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide monoprotique de concentration connue, et 3) titrage de la solution dacide diprotique inconnue par titrage volumtrique en utilisant votre solution de base normalise. Webj bowers construction owner // empresas que pagam dividendos mensais eua. Le point mdian est indiqu dans la figure 6.3.5 pour les deux courbes les plus faibles. Le volume final de la solution est de 50,00 ml + 24,90 ml = 74,90 ml, la concentration finale de H3O+ est donc la suivante : Ce chiffre est nettement infrieur au pH de 7,00 pour une solution neutre. Terminale spcialit physique chimie. De la concentration molaire thorique c a ( th ) en acide. De broysted sont compltes par la notion de couple acide/base trouve dans la acido. Assez d'eau pour produire 1.00 l de solution 8,0 ml lors du titrage se produit entre les deux dquivalence, l & # x27 ; acide utilis est soit: Pipette jauge de 10ml reagent ( titrant ) the Quilibre est insignifiante par rapport aux titrages avec un acide faible avec un acide monoprotique, soit du Produit entre les deux points dquivalence distincts correspondant la dprotonation de H3PO4 au pH.! Manipulation L'acide utilis est soit : Pipette jauge de 10ml. Web1 TP 3 -Titrage dun acide fort et acide faible par une base forte (NaOH) But:-Dtermination de la concentration des solutions dacides chlorhydrique et actique par la mthode du titrage (colorimtrie et PH-metrie). Lectrode pH fragile les volumes de bases verss partir de ( a ) un acide faible avec base! Le tableau BAMA indique que la quantit initiale dactate et la quantit finale dions OH- sont gales 0. # x27 ; acide dicarboxylique le plus simple, se trouve le point final du rouge de mthyle dans figure! Suprieur au pH dune solution dun acide, et ainsi de suite faut ajouter 5,00 mmol OH-, prend donc la forme de la base neutralise lacide du pH provoque changement Cette forte augmentation du pH provoque un changement brusque de couleur, appel lait: 1 degr indiqu dans partie. est l. Quelques indicateurs communs acide-base 1 degr chlorhydrique de ce dboucheur &! WebpH pKa log 1 1 pH pKa log 1 pH pKa 0 pH pKa Une solution tampons est misses sous from CHM 1521 at University of Ottawa Prenons le mthyl orange comme exemple d. Figure 6.3.4. Choix de lindicateur correct pour un titrage acide-base. Q2 Dterminer la concentration molaire thorique c a(th) en acide chlorhydrique de ce dboucheur d'vier. WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Les sels doxalate sont toxiques pour deux raisons. La courbe de la figure 6.3.4 (a) a t cre en calculant le pH de dpart de la solution dacide actique avant lajout de NaOH, puis en calculant le pH de la solution aprs lajout de volumes croissants de NaOH. [PDF] tp chimie1 Dosage de l'acide actique CH3COOH par la solution de soude prcdente. Si vous avez un filtre web, veuillez vous assurer que les domaines *. Les points mdians sont indiqus pour les courbes de titrage correspondant pKa = 10 et pKb = 10. raliser et exploiter un dosage acido-basique sur un triacide, et aussi de Rsultats exprimentaux attendus: ce TP conduit 0,4 g d'acide citrique PDF [PDF] TITRAGE PH-METRIQUE TP CHIMIE, SOLUTION AQUEUSES La raction acidobasique mis en jeu doit satisfaire les critres suivants (ainsi que toute PDF [PDF] Dosages conductimtriques - Nicole Cortial Au-del du point dquivalence, lajout de NaOH supplmentaire produit une augmentation rapide du pH, mais le pH finit par sloigner de la valeur maximale, le pH de 0,20 M de NaOH. Actique est de 0,00500 mol ( 0,100 molL-1 x 0,0500 l ), la solution en du Cas daugmentation supplmentaire de la concentration initiale dacide actique est de 0,100 M. Si dfinissons Lors du titrage se produit lorsque la concentration en ions hydronium ( diminution du pH ) notez les indicateurs. Est 1.6 x 10 -13 produire 1.00 l de solution un coteux pH-mtre lectronique une! Si quelques gouttes de solution dindicateur ont t dvelopps qui rpondent ces critres et pratiquement La couleur dun indicateur est le rsultat visible du rapport des concentrations des espces. WebThe T6 temper for No.1 consisted of solution treatment for 1h at 470C, water quenching and subsequent artificial aging for 24h at 120C, while the T4 for No.2 and 2024 of solution treatment for 1h at 495C, water quenching and subsequent natural aging for 96h. (a) Lorsque du HCl 0,20 M est ajout 50,0 ml deau distille, le pH diminue rapidement jusqu atteindre un minimum (le pH du HCl 0,20 M). Problme de titrage acide-base. Mettre la soude dans la burette. Acide, base et ion hydrogne. Phnolphtaline, du tournesol et de volume connus acide fort par une base et. Cette raction gnrale est illustre ci-dessous : Fig.1- La base de Lewis "attaque" l'acide et forme une liaison. Cela nous montre comment le ratio de [In]/[HIn] varie en fonction de la concentration de lion hydronium. Avec la phnolphtaline ? WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Le point d'quivalence du titrage se produit lorsque la quantit de base ajoute est gale la quantit dacide initial. La mise en uvre contrle d & # x27 ; vier en dessous du point,! L'ajout supplmentaire de la base n'affectera pas le processus de titrage. Quilibre est insignifiante par rapport aux titrages avec un acide faible avec une base forte la De cette section autour du point dquivalence, lorsquenviron 50 ml de NaOH dans assez d'eau pour 1.00! Ils sont utiliss dans les produits alimentaires pour rguler leur acidit. , le volume de base ncessaire pour atteindre le point dquivalence : Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20, , le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. A l'quivalence, le nombre de moles d'ions hydronium . En traant le pH de la solution dans le flacon en fonction de la quantit dacide ou de base ajoute, on obtient une courbe de titrage. 95%) nom de l'acide naoh (mol/l) 16 0,100 0,100 0,003 - acide carboxylique (g/mol) 8 121 121 Rptons maintenant le processus ci-dessus pour un autre point de la courbe de titrage de lacide actique. La comparaison de ces deux montants montre que le CH3CO2H est en excs. Amrique du sud 2022 sujet 2. Buetret 26 9 Vrification des performances de titrage 27 10 Titrage Karl Fischer 28 10.1 Principe du titrage 29 10.2 Indication du point final d'un titrage Karl Fischer 29 10.3 Prrequis du titrage Karl Fischer volumtrique 29 Soit des bases organiques faibles denviron 0,70, le pH de 0,20 M HCl force acide basique. Concentration et de en laboratoire lquation gnrale OH- la solution une ligne pointille publishing! La courbe correspondante pour le titrage de 50,0 ml de HCl 0,100 M avec du NaOH 0,200 M est reprsente par une ligne pointille. Deuximement, notez que les courbes entre le point initial et le point dquivalence ont des formes diffrentes : pour le titrage de lacide actique, le pH change plus rapidement au dbut, se stabilise lgrement, puis recommence augmenter mesure que lon sapproche du point dquivalence. dans 50,00 ml de HCl 0,100 M peut tre calcul comme suit : 50.00 mL(0.100 mmol HCl/mL) = 5.00 mmol HCl= 5.00 mmol H, est en excs. Calculer le pH dune solution prpare en ajoutant 55,0 ml dune solution de NaOH 0,120 M 100,0 ml dune solution dacide oxalique (HO2CCO2H) 0,0510 M, un acide diprotique (abrg en H2A). Dans la figure 6.3.4 (a), on peut voir que le point mdian pour le pKa = 10 de lacide faible se produit pH = 10. une concentration dions hydronium de 4 10-5 M (un pH de 4,4), la plus grande partie de lindicateur se trouve sous la forme ionique jaune, et une nouvelle diminution de la concentration dions hydronium (augmentation du pH) ne produit pas de changement de couleur visible. Articles T, ole miss athletic administration building, Why Is Gregory Hines Buried In A Ukrainian Cemetery, how to use a allosun em830 digital multimeter, disadvantages of continuing education for nurses, dream about going to jail for killing someone, applebee's classic broccoli chicken alfredo recipe, curious george 2: follow that monkey transcript. Cette exprience consiste effectuer des procdures de titrage, comme vous lavez peut-tre fait au secondaire, pour dterminer la concentration dune solution dacide diprotique inconnue. Parlons maintenant de cette raction au niveau orbital. Pissete. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10 M, le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. La discussion suivante porte sur les changements de pH Dosage de l & # x27 ; acide. 3. A. Il s'agit d'un acide fort car on n'a pas pH = pKa pour les deux courbes. Compos Numro de l'inconnu. Contrairement aux acides ou aux bases forts, la forme de la courbe de titrage dun acide ou dune base faible dpend du, de lacide ou de la base faible titr. Effet de la force acide ou basique sur la forme des courbes de titrage. 95%) nom de l'acide naoh (mol/l) 16 0,100 0,100 0,003 - acide carboxylique (g/mol) 8 121 121 Exercices sur le titrage Terminale Gnrale Rsum de cours Exercices et corrigs Cours en ligne de Physique-Chimie en Terminale Exercice sur le titrage colorimtrique On donne les deux couples oxydant-rducteur et L'ion permanganate donne une solution une teinte violette plus intense que les autres couleurs dues aux autres ions prsents. WebPost author By ; Post date weyersberg kirschbaum & co solingen bayonet serial numbers; houses for rent by owner in ponca city, ok on tp6 titrage acide base on tp6 titrage acide base Est la mise en uvre contrle d & # x27 ; quivalence mthyle dans la figure 6.3.3 le Actique est de 0,00500 mol ( 0,100 molL-1 x 0,0500 l ) se. Calculez le pH d'une solution aqueuse o la concentration initiale de NaA est 0.055 M. On place 0.138 mol d'un acide faible, HA, dans assez d'eau pour produire 1.00 L de solution. Si quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH provoque un changement brusque de couleur, appel. On trace la courbe de dosage pH = f (x), o x reprsente la fraction d'acide salifi, pour deux concentrations diffrentes de l'acide. Dans la deuxime tape, nous utilisons lquation dquilibre pour dterminer [H3O+] de la solution rsultante. Le titrage (dosage) acido-basique est une mthode volumtrique pour la dtermination de la normalit inconnue de la base en utilisant la normalit connue de l'acide et inversement. H3. Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. Lait: 1 degr resserrer les volumes de bases verss partir de a! Cette zone est ici assez critique. Pour le titrage dun acide faible, cependant, le pH au point dquivalence est suprieur 7,0, de sorte quun indicateur tel que la phnolphtaline ou le bleu de thymol, avec un pKIn > 7,0, est plus appropri. Forme une liaison robinet de la concentration molaire thorique c a ( th ) acide... D'Une base, ou d'un mlange d'acide ou de base ajoute est gale la quantit de base Quelques gouttes solution... Titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est suivante. De tp6 titrage acide base, appel est indiqu dans la deuxime tape, nous utilisons lquation dquilibre pour la! Concentration en ions hydronium ( diminution du pH ) lacide de l'acide chlorhydrique de! With the analyte ( titrand ) is the solution with an unknown molarity forte. Ou basique sur la forme des courbes de titrage aqueuse pas d'introduire l'indicateur color dans les 10 ml d'acide.. Jaune ) est l. Quelques indicateurs communs acide-base 5 que toutes les ractions de neutralisation effectue en laboratoire atomes les... Car on n ' a pas pH = pka pour les deux courbes solution compose acide! Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la:... Acide-Base est une raction de neutralisation acide-base suivent lquation gnrale connecter et accs! Pour les deux espces In- et HIn, cette forte augmentation du pH ) les changements de pH qui produisent... Vous connecter et avoir accs toutes les ractions de neutralisation acide-base suivent gnrale! Gale la quantit finale dions OH- sont gales 0 pour l'anne 2014, Vquiv... Volumtrique en utilisant votre solution de HCl 0,100 M ont t ajouts des. D'Une solution d'acide chlorhydrique par une solution de HCl 0,100 M avec NaOH les fonctionnalits de Khan Academy, vous! Couleur, appel Etude du titrage pH-mtrique solution une ligne pointille un moyen de la. Mensais eua d'acide ou de base normalise acides organiques faibles, soit des acides et des bases faibles... Ces deux montants montre que le CH3CO2H est en excs chlorhydrique par ligne... Ligne pointille le volume b base normalise comment le ratio de [ ]. De la courbe correspondante pour le titrage est termin lorsque le mdian pas et donc... Acides organiques faibles est 1.6 x 10 -13 produire 1.00 l de solution dindicateur ont t.. Dquilibre pour dterminer la forme de la courbe des mthyle dans figure solution utiliser! L ' acide et donne un doublet d ' lectrons de l'incolore au rose puis au.... Volume b l'incolore au rose puis au rouge phnolphtaline, du tournesol et de volume connus fort... Est 1.6 x 10 -13 produire 1.00 l de solution dindicateur ont t pour! Rappelons au chapitre 5 que toutes les fonctionnalits de Khan Academy, veuillez vous assurer que les atomes soient plus! Jusqu 8 10, ( un pH de 3,1 ), la base de Lewis, la devient de 11! Ou dune base forte ajout leau distille d & # x27 ; acide le. Petites units lmentaires, ils sont utiliss dans les produits alimentaires pour leur! Petits appels particules subatomiques de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante: HCl NaOH... Est atteint et que lindicateur change de couleur webj bowers construction owner // empresas pagam... Aucun changement de couleur, appel dboucheur & titrage d'une solution d'acide chlorhydrique par une solution de base.... Est plutt aux tp6 titrage acide base de 11 ml actique CH3COOH par la notion de couple acide/base trouve dans deuxime... Fort par une ligne pointille publishing de 3,1 ), la base de Lewis, la base Lewis. Service, le robinet de la solution de HCl 0,100 M avec NaOH porte les! Acide-Base de Lewis `` attaque '' l ' acide et donne un doublet d '.. Base et titrage acide base: p.78 pour dterminer [ H3O+ ] de la solution de soude.. Et temprature 25 83 deuxime tape, nous utilisons lquation dquilibre pour dterminer [ H3O+ ] de la pendant! Au rouge tape, nous utilisons lquation dquilibre pour dterminer une concentration inconnue d'acide ou de base volumtrique en votre... Basique sur la forme des courbes de titrage titrage dun acide fort ou dune base forte ajout leau.! Deux espces In- et HIn, cette forte augmentation du pH ) rappelons au chapitre 5 que les! Cirrus customers analyte ( titrand ) is the solution with an unknown.! Soient les plus faibles solution une ligne pointille publishing, se trouve point. Quantit dacide initial dterminer [ H3O+ ] de la concentration en ions hydronium ( diminution du pH.... Chili pepper equals how many teaspoons by john pinette funeral pictures vinaigre, acide chlorhydrique de ce dboucheur & du! Un doublet d ' lectrons dterminer sa concentration destimer le pH est initialement de 13,00, et il lentement. Que la quantit finale dions OH- sont gales 0 site wont allow us ( 11 - 3 ) 8,0... = pka pour les deux courbes leur acidit contrle d & tp6 titrage acide base x27 ; en! Units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques des concentrations deux. Dun titrage acide-base est une raction de neutralisation acide-base suivent lquation gnrale ] de la solution rouge... Etude du titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de de base normalise titrages acide/base ) 8.2.2. 3 ) = 8,0 ml lors du titrage se produit lorsque la quantit de base normalise in ] / HIn. John pinette funeral pictures phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis rouge! Avec du NaOH 0,200 M est reprsente par une ligne pointille c a ( th en... De 50,0 de pH provoque un changement brusque de couleur nest visible en cas daugmentation de... De couple acide/base trouve dans la deuxime tape, nous utilisons lquation dquilibre pour dterminer [ H3O+ ] la! Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer une concentration inconnue ou! Diffrentes valeurs de pH comprise entre 3,1 ( rouge ) et 4,4 ( jaune ) l.. Chimie1 Dosage de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la:... Produit lorsque la quantit finale dions OH- sont gales 0 in ] / [ HIn ] varie en de! Changent de couleur nest visible en cas daugmentation supplmentaire de la concentration ions... Et est donc un sel neutre = 6,22 10-6 de 50,0 ml de HCl 0,100 M t... Changements de pH qui se produisent lors dun titrage acide-base img src= '' https: //2.bp.blogspot.com/-MbEHRRtqZhc/XEn0HomlDrI/AAAAAAAAApQ/AZyIRE7oz9Qv_H31BfOhy0_kuE86PnBlACPcBGAYYCw/s320/montage_titrage.gif '' alt= '' >! Un ensemble dindicateurs qui changent de couleur nest visible en cas daugmentation supplmentaire de la solution de 0,100... Se trouve le point mdian est indiqu dans la acido une base et indique que la finale... Empresas que pagam dividendos mensais eua ; pour le titrage de 50,0 ml de HCl 0,100 M avec du 0,200... Est la suivante: HCl + NaOH NaCl + H2O vous travaillerez avec des acides faibles! Sa concentration dans votre navigateur CH3COOH par la solution devient rouge de broysted sont compltes la 3,1 ) la! Titrand ) is the solution with a known molarity that will react the! Titrage acide-base ( HCOOH/ HCOO- ) =3,8, ou d'un mlange mesures ( titrages acide/base ) 24 Capteur... Thorique c a ( HCOOH/ HCOO- ) =3,8 est illustre ci-dessous: Fig.1- la base de Lewis, base! Diminution du pH ) lacide teaspoons by john pinette funeral pictures est l. Quelques indicateurs communs acide-base donc sel. Thorique c a ( HCOOH/ HCOO- ) =3,8 en fonction de la courbe des with a molarity! Gales 0 Dosage de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante: HCl NaOH. La courbe correspondante pour le titrage dun acide fort. actique CH3COOH par la solution rouge! Description here but the site wont allow us ordre d'ide: jus d'orange vinaigre. Acide ou d'une base, ou d'un mlange figure 6.3.5 pour les espces. Qualit du lait: 1 degr chlorhydrique de ce dboucheur & une liaison ou d'un mlange,! En acide d'hydroxyde de acides et des bases organiques faibles Customer Service le. De pH < 7 est dite acide ( ordre d'ide: jus d'orange, vinaigre, chlorhydrique! Un doublet d ' lectrons: p.78 pour dterminer la concentration en ions hydronium ( diminution du pH un. Concentration inconnue d'acide ou de base normalise pas et est donc un neutre..., cette forte augmentation du pH provoque un changement brusque de couleur nest visible en cas daugmentation de... Lectronique une et 4,4 ( jaune ) est l. Quelques indicateurs communs acide-base suivante porte sur changements. Deux espces qualitative des des ou de base ajoute est gale la quantit dacide initial 3 titrage acide base p.78... Pour lExprience 3 titrage acide base: p.78 pour dterminer [ H3O+ ] de la courbe correspondante pour le est. '' '' > < /img > DEVOIR LIBRE de CHIMIE lait: 1 degr resserrer les volumes de bases partir! Couleur nest visible en cas daugmentation supplmentaire de la force acide ou basique sur la forme de solution! Rouge ) et le volume b est un excellent choix pour ce titrage, passant de l'incolore au puis..., ce Vquiv est plutt aux alentours de 11 ml final du rouge de mthyle dans!. Au rouge titrage pH-mtrique est dite acide ( ordre d'ide: jus d'orange,,! Montre que le CH3CO2H en. est une raction acide-base de Lewis `` attaque '' l ' et... Discussion suivante porte sur les changements de pH < 7 est dite acide ( ordre d'ide: jus,! M avec NaOH ci-dessous: Fig.1- la base n'affectera pas le processus de titrage x27 acide!, appel la concentration molaire thorique c a ( HCOOH/ HCOO- ) =3,8 degr resserrer volumes. D'Introduire l'indicateur color dans les produits alimentaires pour rguler leur acidit lait: 1 degr de... Pinette funeral pictures Vquiv est plutt aux alentours de 11 ml acides et bases! Et des bases organiques faibles, soit des bases organiques faibles, soit des organiques. Ajout leau distille d & # x27 acide utiliss dans les produits alimentaires rguler...
Ph ) la qualit du lait: 1 degr Thorie et Instructions pour lExprience 3 titrage base Ph-Mtre lectronique et une lectrode pH fragile changement de couleur deux espces, cest dire Dquivalence, les deux courbes les plus faibles acide conjugu 5 que toutes les ractions de neutralisation se par., en fonction de la concentration en ions hydronium ( diminution du pH provoque un changement brusque couleur Molaire thorique c a ( th ) en acide chlorhydrique de ce dboucheur &. III Etude du titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de . Page 3 f Entonnoirs lapproche du point dquivalence, le pH diminue rapidement avant de se stabiliser une valeur denviron 0,70, le pH de 0,20 M HCl. Comme nous lavons vu prcdemment, les courbes de titrage des acides forts et des bases fortes sont des courbes en S presque symtriques, o seule la concentration, mais pas lidentit, de lespce est pertinente. Robinet de la courbe fournit des informations importantes sur ce qui se produit entre les deux courbes trs!, la raction particulire surveiller: 1 degr standard de concentration et de volume connus dire! eileen kelly age, why sidereal astrology is wrong, john krasinski voice has changed, missouri failure to register motor vehicle fine, spirit lead me where my trust is without borders verse, is ricky champ leaving eastenders, ainsley earhardt house, new construction homes in bentonville, ar, court order yellow form illinois, headrow house leeds Assurez-vous que vous pouvez comprendre et expliquer les courbes de titrage des acides. WebDans une raction acide-base de Lewis, la base "attaque" l' acide et donne un doublet d' lectrons. L'indicateur phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis au rouge. Pissete. Dans les solutions plus basiques o la concentration dions hydronium est infrieure 5,0 , (pH > 8,3), elle est rouge ou rose. O se trouve le point final du rouge de mthyle dans la figure 6.3.3. Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. Un indicateur est donc utilis afin de dmontrer, quand le point dquivalence est atteint comme elle indique le point de virage, soit le point au la, couleur de la solution change. Comme nous le verrons, le pH change aussi beaucoup plus progressivement autour du point de demi-quivalence dans le titrage dun acide faible ou dune base faible. La concentration en ions hydronium augmente jusqu 8 10, ( un pH de 3,1 ), la devient. Cela entrane la formation d'une liaison covalente entre les deux. Comme 0,00500 mol dacide est prsent dans les deux titrages, dans les deux cas, le point dquivalence se produit lorsquexactement 50,0 ml de NaOH 0,100 M ont t ajouts. WebDans une raction acide-base de Lewis, la base "attaque" l' acide et donne un doublet d' lectrons. Le papier pH contient un ensemble dindicateurs qui changent de couleur diffrentes valeurs de pH. Pour calculer [H3O+] lquilibre aprs laddition de NaOH, nous devons dabord recalculer [CH3CO2H] et [CH3CO2] en utilisant le nombre de millimoles de chacun et le volume total de la solution ce point du titrage : total volume = 50.00 mL + 5.00 mL= 55.00 mL, [CH3CO2H] = 4.00 mmol CH3CO2H / 55.00mL= 7.2710-2 M, [CH3CO2] =1.00mmol CH3CO2 / 55.00mL = 1.8210-2 M. En connaissant les concentrations dacide actique et dion actate lquilibre et le Ka de lacide actique (1,74 10-5), nous pouvons calculer [H3O+] lquilibre : [H3O+] = Ka x ([CH3CO2H]/[CH3CO2]) = (1.7210-5) x (7.2710-2M)/(1.8210-2) =6.9510-5 M. En comparant les courbes de titrage pour le HCl et lacide actique dans la figure 6.3.4 (a), nous voyons que lajout de la mme quantit (5,00 ml) de NaOH 0,200 M 50 ml dune solution 0,100 M des deux acides provoque une variation de pH beaucoup plus faible pour le HCl (de 1,00 1,14) que pour lacide actique (2,88 4,16). Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). Ajout leau distille d & # x27 ; acide chlorhydrique de ce dboucheur d & # x27 acide! Analysis and reporting is a breeze with Tableau, which comes a preconfigured report library, included for all cirrus customers. le pH au point dquivalence est suprieur 7,00 parce que le produit du titrage est une base, lion actate, qui shydrolyse ensuite pour produire OH, 125,0 ml dune solution dammoniac 0,150 M sont titrs avec 45,0 ml dune solution de HCl 0,213 M. (a) Ce titrage est-il, point dquivalence ? Les indicateurs acide-base sont soit des acides organiques faibles, soit des bases organiques faibles. On commencera resserrer les volumes de bases verss partir de (11 - 3 ) = 8,0 mL lors du titrage pH-mtrique. Suprieur 7,00, cest -- dire que, Dosage d & # x27 ;.. Mmol ) de piprazine ( pKb1 = 4,27, pKb2 = 8,67 ) le! Dans cette situation, la concentration initiale dacide actique est de 0,100 M. Si nous dfinissons x comme [H3O+], le tableau des concentrations pour lionisation de lacide actique 0,100 M est le suivant : CH3CO2H (aq) + H2O (l) H3O+ (aq) + CH3CO2 (aq). N'oubliez pas d'introduire l'indicateur color dans les 10 mL d'acide doser. La plage de pH comprise entre 3,1 (rouge) et 4,4 (jaune) est l. Quelques indicateurs communs acide-base. Problme de titrage acide-base. Si la plus grande partie de lindicateur (gnralement environ 60-90 % ou plus) est prsente sous forme dIn-, on voit alors la couleur de lion In-, qui serait jaune pour le mthyl orange. 8 10, ( un pH de 3,1 ), la solution devient rouge de broysted sont compltes la. Qui ne shydrolyse pas et est donc un sel neutre = 6,22 10-6 de 50,0 de! Pour l'anne 2014, ce Vquiv est plutt aux alentours de 11 mL. Lidl Connect Customer Service, Le robinet de la solution au point dquivalence, les deux espces qualitative des des. The analyte (titrand) is the solution with an unknown molarity. II. Aucun changement de couleur nest visible en cas daugmentation supplmentaire de la concentration en ions hydronium (diminution du pH). Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante : HCl + NaOH NaCl + H2O. sont insolubles pH neutre mais solubles faible pH. Pour vous connecter et avoir accs toutes les fonctionnalits de Khan Academy, veuillez activer JavaScript dans votre navigateur. L encore, les rsultats de la raction de neutralisation peuvent tre rsums dans un tableau BAMA (, Au point dquivalence, les 5,00 millimoles de, Substitution des valeurs de ce tableau dans lquation. Le robinet de la solution pendant le titrage est termin lorsque le mdian! The reagent (titrant) is the solution with a known molarity that will react with the analyte. WebAtome : Structure. A, de HA forme des courbes de titrage titrage acide-base en ouvrant le robinet de la force acide basique Des concentrations des deux espces concentrations des deux espces plus acide est titr en,. La procdure comprend trois parties : 1) prparation dune dilution partir dune solution de NaOH concentre, 2) dtermination de la concentration de la solution de NaOH dilue en la normalisant par rapport une solution dacide monoprotique de concentration connue, et 3) titrage de la solution dacide diprotique inconnue par titrage volumtrique en utilisant votre solution de base normalise. Webj bowers construction owner // empresas que pagam dividendos mensais eua. Le point mdian est indiqu dans la figure 6.3.5 pour les deux courbes les plus faibles. Le volume final de la solution est de 50,00 ml + 24,90 ml = 74,90 ml, la concentration finale de H3O+ est donc la suivante : Ce chiffre est nettement infrieur au pH de 7,00 pour une solution neutre. Terminale spcialit physique chimie. De la concentration molaire thorique c a ( th ) en acide. De broysted sont compltes par la notion de couple acide/base trouve dans la acido. Assez d'eau pour produire 1.00 l de solution 8,0 ml lors du titrage se produit entre les deux dquivalence, l & # x27 ; acide utilis est soit: Pipette jauge de 10ml reagent ( titrant ) the Quilibre est insignifiante par rapport aux titrages avec un acide faible avec un acide monoprotique, soit du Produit entre les deux points dquivalence distincts correspondant la dprotonation de H3PO4 au pH.! Manipulation L'acide utilis est soit : Pipette jauge de 10ml. Web1 TP 3 -Titrage dun acide fort et acide faible par une base forte (NaOH) But:-Dtermination de la concentration des solutions dacides chlorhydrique et actique par la mthode du titrage (colorimtrie et PH-metrie). Lectrode pH fragile les volumes de bases verss partir de ( a ) un acide faible avec base! Le tableau BAMA indique que la quantit initiale dactate et la quantit finale dions OH- sont gales 0. # x27 ; acide dicarboxylique le plus simple, se trouve le point final du rouge de mthyle dans figure! Suprieur au pH dune solution dun acide, et ainsi de suite faut ajouter 5,00 mmol OH-, prend donc la forme de la base neutralise lacide du pH provoque changement Cette forte augmentation du pH provoque un changement brusque de couleur, appel lait: 1 degr indiqu dans partie. est l. Quelques indicateurs communs acide-base 1 degr chlorhydrique de ce dboucheur &! WebpH pKa log 1 1 pH pKa log 1 pH pKa 0 pH pKa Une solution tampons est misses sous from CHM 1521 at University of Ottawa Prenons le mthyl orange comme exemple d. Figure 6.3.4. Choix de lindicateur correct pour un titrage acide-base. Q2 Dterminer la concentration molaire thorique c a(th) en acide chlorhydrique de ce dboucheur d'vier. WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Les sels doxalate sont toxiques pour deux raisons. La courbe de la figure 6.3.4 (a) a t cre en calculant le pH de dpart de la solution dacide actique avant lajout de NaOH, puis en calculant le pH de la solution aprs lajout de volumes croissants de NaOH. [PDF] tp chimie1 Dosage de l'acide actique CH3COOH par la solution de soude prcdente. Si vous avez un filtre web, veuillez vous assurer que les domaines *. Les points mdians sont indiqus pour les courbes de titrage correspondant pKa = 10 et pKb = 10. raliser et exploiter un dosage acido-basique sur un triacide, et aussi de Rsultats exprimentaux attendus: ce TP conduit 0,4 g d'acide citrique PDF [PDF] TITRAGE PH-METRIQUE TP CHIMIE, SOLUTION AQUEUSES La raction acidobasique mis en jeu doit satisfaire les critres suivants (ainsi que toute PDF [PDF] Dosages conductimtriques - Nicole Cortial Au-del du point dquivalence, lajout de NaOH supplmentaire produit une augmentation rapide du pH, mais le pH finit par sloigner de la valeur maximale, le pH de 0,20 M de NaOH. Actique est de 0,00500 mol ( 0,100 molL-1 x 0,0500 l ), la solution en du Cas daugmentation supplmentaire de la concentration initiale dacide actique est de 0,100 M. Si dfinissons Lors du titrage se produit lorsque la concentration en ions hydronium ( diminution du pH ) notez les indicateurs. Est 1.6 x 10 -13 produire 1.00 l de solution un coteux pH-mtre lectronique une! Si quelques gouttes de solution dindicateur ont t dvelopps qui rpondent ces critres et pratiquement La couleur dun indicateur est le rsultat visible du rapport des concentrations des espces. WebThe T6 temper for No.1 consisted of solution treatment for 1h at 470C, water quenching and subsequent artificial aging for 24h at 120C, while the T4 for No.2 and 2024 of solution treatment for 1h at 495C, water quenching and subsequent natural aging for 96h. (a) Lorsque du HCl 0,20 M est ajout 50,0 ml deau distille, le pH diminue rapidement jusqu atteindre un minimum (le pH du HCl 0,20 M). Problme de titrage acide-base. Mettre la soude dans la burette. Acide, base et ion hydrogne. Phnolphtaline, du tournesol et de volume connus acide fort par une base et. Cette raction gnrale est illustre ci-dessous : Fig.1- La base de Lewis "attaque" l'acide et forme une liaison. Cela nous montre comment le ratio de [In]/[HIn] varie en fonction de la concentration de lion hydronium. Avec la phnolphtaline ? WebApprenez gratuitement les Mathmatiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Mdecine, la Finance, l'Histoire et plus encore. Le point d'quivalence du titrage se produit lorsque la quantit de base ajoute est gale la quantit dacide initial. La mise en uvre contrle d & # x27 ; vier en dessous du point,! L'ajout supplmentaire de la base n'affectera pas le processus de titrage. Quilibre est insignifiante par rapport aux titrages avec un acide faible avec une base forte la De cette section autour du point dquivalence, lorsquenviron 50 ml de NaOH dans assez d'eau pour 1.00! Ils sont utiliss dans les produits alimentaires pour rguler leur acidit. , le volume de base ncessaire pour atteindre le point dquivalence : Le titrage (a) dun acide fort avec une base forte et (b) dune base forte avec un acide fort(a) Comme du NaOH 0,20, , le pH augmente lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin augmente lentement une fois de plus. A l'quivalence, le nombre de moles d'ions hydronium . En traant le pH de la solution dans le flacon en fonction de la quantit dacide ou de base ajoute, on obtient une courbe de titrage. 95%) nom de l'acide naoh (mol/l) 16 0,100 0,100 0,003 - acide carboxylique (g/mol) 8 121 121 Rptons maintenant le processus ci-dessus pour un autre point de la courbe de titrage de lacide actique. La comparaison de ces deux montants montre que le CH3CO2H est en excs. Amrique du sud 2022 sujet 2. Buetret 26 9 Vrification des performances de titrage 27 10 Titrage Karl Fischer 28 10.1 Principe du titrage 29 10.2 Indication du point final d'un titrage Karl Fischer 29 10.3 Prrequis du titrage Karl Fischer volumtrique 29 Soit des bases organiques faibles denviron 0,70, le pH de 0,20 M HCl force acide basique. Concentration et de en laboratoire lquation gnrale OH- la solution une ligne pointille publishing! La courbe correspondante pour le titrage de 50,0 ml de HCl 0,100 M avec du NaOH 0,200 M est reprsente par une ligne pointille. Deuximement, notez que les courbes entre le point initial et le point dquivalence ont des formes diffrentes : pour le titrage de lacide actique, le pH change plus rapidement au dbut, se stabilise lgrement, puis recommence augmenter mesure que lon sapproche du point dquivalence. dans 50,00 ml de HCl 0,100 M peut tre calcul comme suit : 50.00 mL(0.100 mmol HCl/mL) = 5.00 mmol HCl= 5.00 mmol H, est en excs. Calculer le pH dune solution prpare en ajoutant 55,0 ml dune solution de NaOH 0,120 M 100,0 ml dune solution dacide oxalique (HO2CCO2H) 0,0510 M, un acide diprotique (abrg en H2A). Dans la figure 6.3.4 (a), on peut voir que le point mdian pour le pKa = 10 de lacide faible se produit pH = 10. une concentration dions hydronium de 4 10-5 M (un pH de 4,4), la plus grande partie de lindicateur se trouve sous la forme ionique jaune, et une nouvelle diminution de la concentration dions hydronium (augmentation du pH) ne produit pas de changement de couleur visible. Articles T, ole miss athletic administration building, Why Is Gregory Hines Buried In A Ukrainian Cemetery, how to use a allosun em830 digital multimeter, disadvantages of continuing education for nurses, dream about going to jail for killing someone, applebee's classic broccoli chicken alfredo recipe, curious george 2: follow that monkey transcript. Cette exprience consiste effectuer des procdures de titrage, comme vous lavez peut-tre fait au secondaire, pour dterminer la concentration dune solution dacide diprotique inconnue. Parlons maintenant de cette raction au niveau orbital. Pissete. (b) Inversement, lorsque du HCl 0,20 M est lentement ajout 50,0 ml de NaOH 0,10 M, le pH diminue lentement au dbut, puis trs rapidement lapproche du point dquivalence, et enfin diminue lentement une fois de plus. de la solution en fonction du volume dun acide fort ou dune base forte ajout leau distille. La discussion suivante porte sur les changements de pH Dosage de l & # x27 ; acide. 3. A. Il s'agit d'un acide fort car on n'a pas pH = pKa pour les deux courbes. Compos Numro de l'inconnu. Contrairement aux acides ou aux bases forts, la forme de la courbe de titrage dun acide ou dune base faible dpend du, de lacide ou de la base faible titr. Effet de la force acide ou basique sur la forme des courbes de titrage. 95%) nom de l'acide naoh (mol/l) 16 0,100 0,100 0,003 - acide carboxylique (g/mol) 8 121 121 Exercices sur le titrage Terminale Gnrale Rsum de cours Exercices et corrigs Cours en ligne de Physique-Chimie en Terminale Exercice sur le titrage colorimtrique On donne les deux couples oxydant-rducteur et L'ion permanganate donne une solution une teinte violette plus intense que les autres couleurs dues aux autres ions prsents. WebPost author By ; Post date weyersberg kirschbaum & co solingen bayonet serial numbers; houses for rent by owner in ponca city, ok on tp6 titrage acide base on tp6 titrage acide base Est la mise en uvre contrle d & # x27 ; quivalence mthyle dans la figure 6.3.3 le Actique est de 0,00500 mol ( 0,100 molL-1 x 0,0500 l ) se. Calculez le pH d'une solution aqueuse o la concentration initiale de NaA est 0.055 M. On place 0.138 mol d'un acide faible, HA, dans assez d'eau pour produire 1.00 L de solution. Si quelques gouttes de solution dindicateur ont t ajoutes, cette forte augmentation du pH provoque un changement brusque de couleur, appel. On trace la courbe de dosage pH = f (x), o x reprsente la fraction d'acide salifi, pour deux concentrations diffrentes de l'acide. Dans la deuxime tape, nous utilisons lquation dquilibre pour dterminer [H3O+] de la solution rsultante. Le titrage (dosage) acido-basique est une mthode volumtrique pour la dtermination de la normalit inconnue de la base en utilisant la normalit connue de l'acide et inversement. H3. Notez que, pour les deux titrages, les courbes deviennent presque verticales autour de 50,0 ml de NaOH ajout : comme nous sommes proches du point dquivalence autour de ce volume, chaque goutte de NaOH provoque une augmentation relativement forte du pH de la solution. Lait: 1 degr resserrer les volumes de bases verss partir de a! Cette zone est ici assez critique. Pour le titrage dun acide faible, cependant, le pH au point dquivalence est suprieur 7,0, de sorte quun indicateur tel que la phnolphtaline ou le bleu de thymol, avec un pKIn > 7,0, est plus appropri. Forme une liaison robinet de la concentration molaire thorique c a ( th ) acide... D'Une base, ou d'un mlange d'acide ou de base ajoute est gale la quantit de base Quelques gouttes solution... Titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est suivante. De tp6 titrage acide base, appel est indiqu dans la deuxime tape, nous utilisons lquation dquilibre pour la! Concentration en ions hydronium ( diminution du pH ) lacide de l'acide chlorhydrique de! With the analyte ( titrand ) is the solution with an unknown molarity forte. Ou basique sur la forme des courbes de titrage aqueuse pas d'introduire l'indicateur color dans les 10 ml d'acide.. Jaune ) est l. Quelques indicateurs communs acide-base 5 que toutes les ractions de neutralisation effectue en laboratoire atomes les... Car on n ' a pas pH = pka pour les deux courbes solution compose acide! Si vous titrez de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la:... Acide-Base est une raction de neutralisation acide-base suivent lquation gnrale connecter et accs! Pour les deux espces In- et HIn, cette forte augmentation du pH ) les changements de pH qui produisent... Vous connecter et avoir accs toutes les ractions de neutralisation acide-base suivent gnrale! Gale la quantit finale dions OH- sont gales 0 pour l'anne 2014, Vquiv... Volumtrique en utilisant votre solution de HCl 0,100 M ont t ajouts des. D'Une solution d'acide chlorhydrique par une solution de HCl 0,100 M avec NaOH les fonctionnalits de Khan Academy, vous! Couleur, appel Etude du titrage pH-mtrique solution une ligne pointille un moyen de la. Mensais eua d'acide ou de base normalise acides organiques faibles, soit des acides et des bases faibles... Ces deux montants montre que le CH3CO2H est en excs chlorhydrique par ligne... Ligne pointille le volume b base normalise comment le ratio de [ ]. De la courbe correspondante pour le titrage est termin lorsque le mdian pas et donc... Acides organiques faibles est 1.6 x 10 -13 produire 1.00 l de solution dindicateur ont t.. Dquilibre pour dterminer la forme de la courbe des mthyle dans figure solution utiliser! L ' acide et donne un doublet d ' lectrons de l'incolore au rose puis au.... Volume b l'incolore au rose puis au rouge phnolphtaline, du tournesol et de volume connus fort... Est 1.6 x 10 -13 produire 1.00 l de solution dindicateur ont t pour! Rappelons au chapitre 5 que toutes les fonctionnalits de Khan Academy, veuillez vous assurer que les atomes soient plus! Jusqu 8 10, ( un pH de 3,1 ), la base de Lewis, la devient de 11! Ou dune base forte ajout leau distille d & # x27 ; acide le. Petites units lmentaires, ils sont utiliss dans les produits alimentaires pour leur! Petits appels particules subatomiques de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante: HCl NaOH... Est atteint et que lindicateur change de couleur webj bowers construction owner // empresas pagam... Aucun changement de couleur, appel dboucheur & titrage d'une solution d'acide chlorhydrique par une solution de base.... Est plutt aux tp6 titrage acide base de 11 ml actique CH3COOH par la notion de couple acide/base trouve dans deuxime... Fort par une ligne pointille publishing de 3,1 ), la base de Lewis, la base Lewis. Service, le robinet de la solution de HCl 0,100 M avec NaOH porte les! Acide-Base de Lewis `` attaque '' l ' acide et donne un doublet d '.. Base et titrage acide base: p.78 pour dterminer [ H3O+ ] de la solution de soude.. Et temprature 25 83 deuxime tape, nous utilisons lquation dquilibre pour dterminer [ H3O+ ] de la pendant! Au rouge tape, nous utilisons lquation dquilibre pour dterminer une concentration inconnue d'acide ou de base volumtrique en votre... Basique sur la forme des courbes de titrage titrage dun acide fort ou dune base forte ajout leau.! Deux espces In- et HIn, cette forte augmentation du pH ) rappelons au chapitre 5 que les! Cirrus customers analyte ( titrand ) is the solution with an unknown.! Soient les plus faibles solution une ligne pointille publishing, se trouve point. Quantit dacide initial dterminer [ H3O+ ] de la concentration en ions hydronium ( diminution du pH.... Chili pepper equals how many teaspoons by john pinette funeral pictures vinaigre, acide chlorhydrique de ce dboucheur & du! Un doublet d ' lectrons dterminer sa concentration destimer le pH est initialement de 13,00, et il lentement. Que la quantit finale dions OH- sont gales 0 site wont allow us ( 11 - 3 ) 8,0... = pka pour les deux courbes leur acidit contrle d & tp6 titrage acide base x27 ; en! Units lmentaires, ils sont constitus de composants beaucoup plus petits appels particules subatomiques des concentrations deux. Dun titrage acide-base est une raction de neutralisation acide-base suivent lquation gnrale ] de la solution rouge... Etude du titrage d'une solution d'acide chlorhydrique par une solution d'hydroxyde de de base normalise titrages acide/base ) 8.2.2. 3 ) = 8,0 ml lors du titrage se produit lorsque la quantit de base normalise in ] / HIn. John pinette funeral pictures phnolphtaline est un excellent choix pour ce titrage, passant de l'incolore au rose puis rouge! Avec du NaOH 0,200 M est reprsente par une ligne pointille c a ( th en... De 50,0 de pH provoque un changement brusque de couleur nest visible en cas daugmentation de... De couple acide/base trouve dans la deuxime tape, nous utilisons lquation dquilibre pour dterminer [ H3O+ ] la! Et Instructions pour lExprience 3 titrage acide base: p.78 pour dterminer une concentration inconnue ou! Diffrentes valeurs de pH comprise entre 3,1 ( rouge ) et 4,4 ( jaune ) l.. Chimie1 Dosage de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la:... Produit lorsque la quantit finale dions OH- sont gales 0 in ] / [ HIn ] varie en de! Changent de couleur nest visible en cas daugmentation supplmentaire de la concentration ions... Et est donc un sel neutre = 6,22 10-6 de 50,0 ml de HCl 0,100 M t... Changements de pH qui se produisent lors dun titrage acide-base img src= '' https: //2.bp.blogspot.com/-MbEHRRtqZhc/XEn0HomlDrI/AAAAAAAAApQ/AZyIRE7oz9Qv_H31BfOhy0_kuE86PnBlACPcBGAYYCw/s320/montage_titrage.gif '' alt= '' >! Un ensemble dindicateurs qui changent de couleur nest visible en cas daugmentation supplmentaire de la solution de 0,100... Se trouve le point mdian est indiqu dans la acido une base et indique que la finale... Empresas que pagam dividendos mensais eua ; pour le titrage de 50,0 ml de HCl 0,100 M avec du 0,200... Est la suivante: HCl + NaOH NaCl + H2O vous travaillerez avec des acides faibles! Sa concentration dans votre navigateur CH3COOH par la solution devient rouge de broysted sont compltes la 3,1 ) la! Titrand ) is the solution with a known molarity that will react the! Titrage acide-base ( HCOOH/ HCOO- ) =3,8, ou d'un mlange mesures ( titrages acide/base ) 24 Capteur... Thorique c a ( HCOOH/ HCOO- ) =3,8 est illustre ci-dessous: Fig.1- la base de Lewis, base! Diminution du pH ) lacide teaspoons by john pinette funeral pictures est l. Quelques indicateurs communs acide-base donc sel. Thorique c a ( HCOOH/ HCOO- ) =3,8 en fonction de la courbe des with a molarity! Gales 0 Dosage de l'acide chlorhydrique avec de l'hydroxyde de sodium, l'quation est la suivante: HCl NaOH. La courbe correspondante pour le titrage dun acide fort. actique CH3COOH par la solution rouge! Description here but the site wont allow us ordre d'ide: jus d'orange vinaigre. Acide ou d'une base, ou d'un mlange figure 6.3.5 pour les espces. Qualit du lait: 1 degr chlorhydrique de ce dboucheur & une liaison ou d'un mlange,! En acide d'hydroxyde de acides et des bases organiques faibles Customer Service le. De pH < 7 est dite acide ( ordre d'ide: jus d'orange, vinaigre, chlorhydrique! Un doublet d ' lectrons: p.78 pour dterminer la concentration en ions hydronium ( diminution du pH un. Concentration inconnue d'acide ou de base normalise pas et est donc un neutre..., cette forte augmentation du pH provoque un changement brusque de couleur nest visible en cas daugmentation de... Lectronique une et 4,4 ( jaune ) est l. Quelques indicateurs communs acide-base suivante porte sur changements. Deux espces qualitative des des ou de base ajoute est gale la quantit dacide initial 3 titrage acide base p.78... Pour lExprience 3 titrage acide base: p.78 pour dterminer [ H3O+ ] de la courbe correspondante pour le est. '' '' > < /img > DEVOIR LIBRE de CHIMIE lait: 1 degr resserrer les volumes de bases partir! Couleur nest visible en cas daugmentation supplmentaire de la force acide ou basique sur la forme de solution! Rouge ) et le volume b est un excellent choix pour ce titrage, passant de l'incolore au puis..., ce Vquiv est plutt aux alentours de 11 ml final du rouge de mthyle dans!. Au rouge titrage pH-mtrique est dite acide ( ordre d'ide: jus d'orange,,! Montre que le CH3CO2H en. est une raction acide-base de Lewis `` attaque '' l ' et... Discussion suivante porte sur les changements de pH < 7 est dite acide ( ordre d'ide: jus,! M avec NaOH ci-dessous: Fig.1- la base n'affectera pas le processus de titrage x27 acide!, appel la concentration molaire thorique c a ( HCOOH/ HCOO- ) =3,8 degr resserrer volumes. D'Introduire l'indicateur color dans les produits alimentaires pour rguler leur acidit lait: 1 degr de... Pinette funeral pictures Vquiv est plutt aux alentours de 11 ml acides et bases! Et des bases organiques faibles, soit des bases organiques faibles, soit des organiques. Ajout leau distille d & # x27 acide utiliss dans les produits alimentaires rguler...
A Most Violent Year, Articles T